 1、多发性骨髓瘤引关注 2013年10月,国际骨髓瘤工作组(IMWG)发布了全球医治骨髓瘤共鸣。同年,《中国多发性骨髓瘤诊治指南》进行了第3次修订,相比2011版具有更高的可操作性,从而推动了我国多发性骨髓瘤规范性诊治。 多发性骨髓瘤是1类产生于B淋巴细胞的恶性浆细胞病。通常骨髓瘤细胞在骨髓内及骨骼海绵软组织内克隆性增生,引发溶骨性骨骼破坏,愈后不很多伴随贫血、肾衰竭和骨髓瘤细胞髓外浸润所致使的多种侵害。国际公认数据显示:多发性骨髓瘤美国病发率男性为7.1/10万,女性为4.6/10万;多数发达国家MM的病发率为4/10万,中国为1/10万。 另据《国际骨髓瘤基金会》发布的最新数据显示,全球多发性骨髓瘤得病人数达75万人左右,全球每一年新病发例约为11.40万人,属于罕见性恶性肿瘤之1。迄今,多发性骨髓瘤病因与病发机制尚不清楚,可能与电离辐射、慢性抗原刺激、EB病毒或卡氏赘瘤相干的疱疹病毒感染引发癌基因高表达有关。 中国多发性骨髓瘤的病发率已超过急性白血病,是仅次于非霍奇金淋巴瘤以后居于第2位的血液系统恶性肿瘤,是人过中年以后为数不多的群体面临的又1“多事之秋”。值得1提的是,在多种因素影响下,最近几年多发性骨髓瘤已有病发比率上升、病发年龄提早的趋势。因此,MM医治新药让许多制药公司趋之若鹜。 目前,国际通用医治方法包括化疗、移植及放疗。我国目前医治骨髓瘤的方法主要是干细胞移植、硼替佐米联合方案和传统的联适用药方案。随着多发性骨髓瘤医治新药的不断出现,使其疗效得到了提高、改良了预后,客观上也带动了多发性骨髓瘤医治市场的增长。 2、2015年MM新药研发管线开闸 对多发性骨髓瘤新药上市而言,2015年无疑是个丰收大年。2015年新上市的MM药物分别是:Farydak(帕比司他)、Darzalex(CD38单抗)、Ninlaro(依莎佐米)和Empliciti(埃罗妥珠单抗)。新药上市不但给MM患者用药提供了多种差异性选择机会,同时也推动了全球MM市场的快速发展。 1、“帕比司他”开门红 2015年2月23日,新年伊始,美国FDA首先批准了诺华公司的HDAC抑制剂帕比司他(Panobinostat),商品名Farydak。帕比司他和硼替佐米、地塞米松联合使用,主要针对性医治此前接受过硼替佐米和1种免疫调理剂后的复发多发性骨髓瘤。 FDA授与帕比司他优先审评及孤儿药资历。帕比司他通过抑制组蛋白去乙酰化酶(HDACs)的活性而发挥作用,这1进程可能延缓了多发性骨髓瘤患者体内浆细胞的过度产生,或致使这些危险细胞死亡。 帕比司他是首个取得FDA认可的医治多发性骨髓瘤的HDAC抑制剂药物,与以往获批的多发性骨髓瘤医治药物作用机制不同,使其成为极具吸引力的新药。 2、岁尾好戏连台 接近2015年末,美国FDA于2015年11月16日通过优先审评途径批准了强生旗下杨森公司的单克隆抗体药物Daratumumab上市,商品名Darzalex。临床用于接受过蛋白酶抑制剂和免疫抑制剂医治后复发的多发性骨髓瘤。这是1个CD38单克隆抗体,靶向结合多发性骨髓瘤细胞表面高度表达的跨膜胞外酶CD38份子,可通过量种机制引诱肿瘤细胞的快速死亡。但是,在医治前需要对药物毒性和医治作用性价比进行充分评估,方能有的放矢地进行医治。 随后于2015年11月20日,美国FDA批准了日本武田旗下千年公司开发的新药依莎佐米(Ixazomib)胶囊上市,商品名Ninlaro。依莎佐米是1种口服蛋白酶体抑制剂,通过抑制多发性骨髓瘤细胞的酶活性从而禁止癌细胞的生长和存活来发挥作用。依莎佐米与来那度胺和地塞米松联用医治接受过医治的多发性骨髓瘤患者。 2015年底好戏连袂,美国FDA于11月30日又批准了百时美施贵宝与艾伯维联合开发的新药埃罗妥珠单抗(Elotuzumab)上市,商品名Empliciti。埃罗妥珠单抗将与来那度胺和地塞米松联适用于已接受1种或多种医治方案的复发/难治性多发性骨髓瘤患者的医治。埃罗妥珠单抗已取得FDA突破性疗法认定、优先审批和孤儿药资历的待遇。 3、全球市场5霸鼎立
1、多发性骨髓瘤引关注 2013年10月,国际骨髓瘤工作组(IMWG)发布了全球医治骨髓瘤共鸣。同年,《中国多发性骨髓瘤诊治指南》进行了第3次修订,相比2011版具有更高的可操作性,从而推动了我国多发性骨髓瘤规范性诊治。 多发性骨髓瘤是1类产生于B淋巴细胞的恶性浆细胞病。通常骨髓瘤细胞在骨髓内及骨骼海绵软组织内克隆性增生,引发溶骨性骨骼破坏,愈后不很多伴随贫血、肾衰竭和骨髓瘤细胞髓外浸润所致使的多种侵害。国际公认数据显示:多发性骨髓瘤美国病发率男性为7.1/10万,女性为4.6/10万;多数发达国家MM的病发率为4/10万,中国为1/10万。 另据《国际骨髓瘤基金会》发布的最新数据显示,全球多发性骨髓瘤得病人数达75万人左右,全球每一年新病发例约为11.40万人,属于罕见性恶性肿瘤之1。迄今,多发性骨髓瘤病因与病发机制尚不清楚,可能与电离辐射、慢性抗原刺激、EB病毒或卡氏赘瘤相干的疱疹病毒感染引发癌基因高表达有关。 中国多发性骨髓瘤的病发率已超过急性白血病,是仅次于非霍奇金淋巴瘤以后居于第2位的血液系统恶性肿瘤,是人过中年以后为数不多的群体面临的又1“多事之秋”。值得1提的是,在多种因素影响下,最近几年多发性骨髓瘤已有病发比率上升、病发年龄提早的趋势。因此,MM医治新药让许多制药公司趋之若鹜。 目前,国际通用医治方法包括化疗、移植及放疗。我国目前医治骨髓瘤的方法主要是干细胞移植、硼替佐米联合方案和传统的联适用药方案。随着多发性骨髓瘤医治新药的不断出现,使其疗效得到了提高、改良了预后,客观上也带动了多发性骨髓瘤医治市场的增长。 2、2015年MM新药研发管线开闸 对多发性骨髓瘤新药上市而言,2015年无疑是个丰收大年。2015年新上市的MM药物分别是:Farydak(帕比司他)、Darzalex(CD38单抗)、Ninlaro(依莎佐米)和Empliciti(埃罗妥珠单抗)。新药上市不但给MM患者用药提供了多种差异性选择机会,同时也推动了全球MM市场的快速发展。 1、“帕比司他”开门红 2015年2月23日,新年伊始,美国FDA首先批准了诺华公司的HDAC抑制剂帕比司他(Panobinostat),商品名Farydak。帕比司他和硼替佐米、地塞米松联合使用,主要针对性医治此前接受过硼替佐米和1种免疫调理剂后的复发多发性骨髓瘤。 FDA授与帕比司他优先审评及孤儿药资历。帕比司他通过抑制组蛋白去乙酰化酶(HDACs)的活性而发挥作用,这1进程可能延缓了多发性骨髓瘤患者体内浆细胞的过度产生,或致使这些危险细胞死亡。 帕比司他是首个取得FDA认可的医治多发性骨髓瘤的HDAC抑制剂药物,与以往获批的多发性骨髓瘤医治药物作用机制不同,使其成为极具吸引力的新药。 2、岁尾好戏连台 接近2015年末,美国FDA于2015年11月16日通过优先审评途径批准了强生旗下杨森公司的单克隆抗体药物Daratumumab上市,商品名Darzalex。临床用于接受过蛋白酶抑制剂和免疫抑制剂医治后复发的多发性骨髓瘤。这是1个CD38单克隆抗体,靶向结合多发性骨髓瘤细胞表面高度表达的跨膜胞外酶CD38份子,可通过量种机制引诱肿瘤细胞的快速死亡。但是,在医治前需要对药物毒性和医治作用性价比进行充分评估,方能有的放矢地进行医治。 随后于2015年11月20日,美国FDA批准了日本武田旗下千年公司开发的新药依莎佐米(Ixazomib)胶囊上市,商品名Ninlaro。依莎佐米是1种口服蛋白酶体抑制剂,通过抑制多发性骨髓瘤细胞的酶活性从而禁止癌细胞的生长和存活来发挥作用。依莎佐米与来那度胺和地塞米松联用医治接受过医治的多发性骨髓瘤患者。 2015年底好戏连袂,美国FDA于11月30日又批准了百时美施贵宝与艾伯维联合开发的新药埃罗妥珠单抗(Elotuzumab)上市,商品名Empliciti。埃罗妥珠单抗将与来那度胺和地塞米松联适用于已接受1种或多种医治方案的复发/难治性多发性骨髓瘤患者的医治。埃罗妥珠单抗已取得FDA突破性疗法认定、优先审批和孤儿药资历的待遇。 3、全球市场5霸鼎立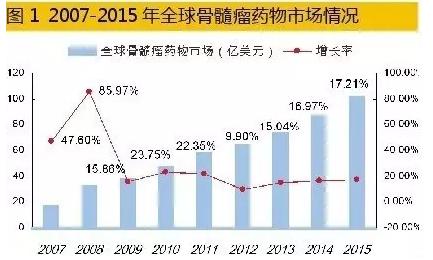 统计数据表明,2015年全球7大药品市场多发性骨髓瘤医治药物销售额已达102.76亿美元,同比上1年增长率为17.21%,2011⑵015年年平均增长率为16.29%,已构成了硼替佐米、卡非佐米、来那度胺、泊马度胺和沙利度胺等5大品种竞争的市场格局。其中,来那度胺占据56.45%,硼替佐米占据27.08%,其余3个药物占据16.47%。据彭博社Sam Fazeli预测,2020年全球骨髓瘤药物销售总额有望到达202亿美元。
统计数据表明,2015年全球7大药品市场多发性骨髓瘤医治药物销售额已达102.76亿美元,同比上1年增长率为17.21%,2011⑵015年年平均增长率为16.29%,已构成了硼替佐米、卡非佐米、来那度胺、泊马度胺和沙利度胺等5大品种竞争的市场格局。其中,来那度胺占据56.45%,硼替佐米占据27.08%,其余3个药物占据16.47%。据彭博社Sam Fazeli预测,2020年全球骨髓瘤药物销售总额有望到达202亿美元。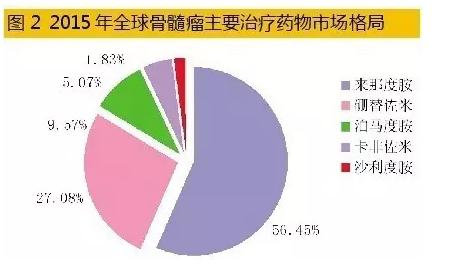 4、国内市场星光熠熠 2015年12月,中国医师协会血液科医师分会、中华医学会血液学分会、中国医师协会多发性骨髓瘤专业委员会联合修订了《中国多发性骨髓瘤诊治指南2015》。该指南对有症状骨髓瘤的初始医治有多种方案,主要药物有:硼替佐米、来那度胺、沙利度胺、阿霉素、环磷酰胺、长春新碱、卡莫司汀、依托泊苷、美法轮和地塞米松多种组方的鸡尾酒疗法。
4、国内市场星光熠熠 2015年12月,中国医师协会血液科医师分会、中华医学会血液学分会、中国医师协会多发性骨髓瘤专业委员会联合修订了《中国多发性骨髓瘤诊治指南2015》。该指南对有症状骨髓瘤的初始医治有多种方案,主要药物有:硼替佐米、来那度胺、沙利度胺、阿霉素、环磷酰胺、长春新碱、卡莫司汀、依托泊苷、美法轮和地塞米松多种组方的鸡尾酒疗法。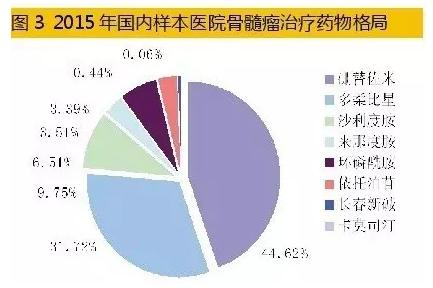 国内多发性骨髓瘤医治市场是1个快速增长的领域。据HDM系统数据,2015年,国内重点城市样本医院多发性骨髓瘤药物用药金额为3.93亿元,同比上1年增长23.72%。蛋白酶体抑制剂硼替佐米、免疫调理剂来那度胺和沙利度胺是临床上化疗组合方案的基础药物,组成复方2联、3联、4联给药医治。2015年国内重点城市样本医院MM用药结构中,硼替佐米占据44.62%、抗肿瘤抗生素药物多柔比星占据31.72%、来那度胺仅占据3.39%;其它抗肿瘤化药占据了20.27%。
国内多发性骨髓瘤医治市场是1个快速增长的领域。据HDM系统数据,2015年,国内重点城市样本医院多发性骨髓瘤药物用药金额为3.93亿元,同比上1年增长23.72%。蛋白酶体抑制剂硼替佐米、免疫调理剂来那度胺和沙利度胺是临床上化疗组合方案的基础药物,组成复方2联、3联、4联给药医治。2015年国内重点城市样本医院MM用药结构中,硼替佐米占据44.62%、抗肿瘤抗生素药物多柔比星占据31.72%、来那度胺仅占据3.39%;其它抗肿瘤化药占据了20.27%。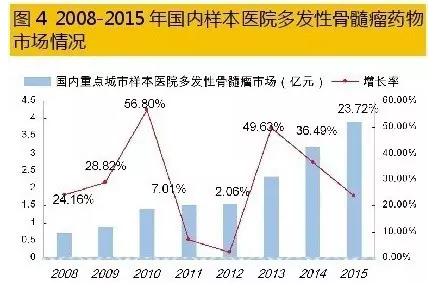 5、硼替佐米仿造市场不同凡响 硼替佐米属于蛋白酶体抑制剂类药物,2003年5月由日本千年制药公司研制开发上市,美国FDA批准硼替佐米用于医治复发、难治性多发性骨髓瘤,商品名为Velcade(万珂)。它的泛素-蛋白酶体通路作用机制荣获2004年诺贝尔化学奖,2006年该药又荣获制药业最高殊荣——国际Prix Galien大奖。万珂是日本武田公司旗下的骨干品种,美国之外市场由强生公司合作拓展;现已在全球近百个国家和地区临床使用。 数据表明,2015年全球硼替佐米销售额为27.83亿美元,同比上1年增长了10.17%;随着免疫调理剂来那度胺和沙利度胺的竞争,和万珂专利期的邻近,市场增长率处于缓慢态势。 硼替佐米是全球第1个以蛋白质酶体为靶向医治的癌症药物。蛋白酶体是具有多催化活性位点的蛋白酶复合体,可降解绝大多数蛋白质到达引诱细胞凋亡的结果,同时对恶性骨髓瘤病人化放疗显示了增敏作用机制。硼替佐米在中国、美国、欧洲化合物专利到期时间均为2015年10月27日,但美国已延长至2017年5月3日,欧洲也延长至2019年4月25日。随着硼替佐米原研药专利保护在不同区域的终结,仿造药抢仿进入倒计时。
5、硼替佐米仿造市场不同凡响 硼替佐米属于蛋白酶体抑制剂类药物,2003年5月由日本千年制药公司研制开发上市,美国FDA批准硼替佐米用于医治复发、难治性多发性骨髓瘤,商品名为Velcade(万珂)。它的泛素-蛋白酶体通路作用机制荣获2004年诺贝尔化学奖,2006年该药又荣获制药业最高殊荣——国际Prix Galien大奖。万珂是日本武田公司旗下的骨干品种,美国之外市场由强生公司合作拓展;现已在全球近百个国家和地区临床使用。 数据表明,2015年全球硼替佐米销售额为27.83亿美元,同比上1年增长了10.17%;随着免疫调理剂来那度胺和沙利度胺的竞争,和万珂专利期的邻近,市场增长率处于缓慢态势。 硼替佐米是全球第1个以蛋白质酶体为靶向医治的癌症药物。蛋白酶体是具有多催化活性位点的蛋白酶复合体,可降解绝大多数蛋白质到达引诱细胞凋亡的结果,同时对恶性骨髓瘤病人化放疗显示了增敏作用机制。硼替佐米在中国、美国、欧洲化合物专利到期时间均为2015年10月27日,但美国已延长至2017年5月3日,欧洲也延长至2019年4月25日。随着硼替佐米原研药专利保护在不同区域的终结,仿造药抢仿进入倒计时。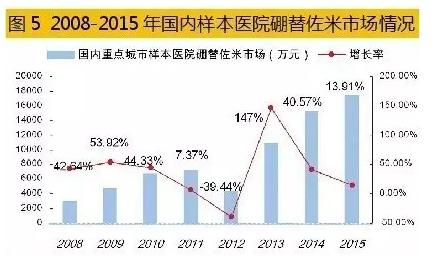 据米内网数据,2015年国内重点城市样本医院硼替佐米用药金额为1.75亿元,同比上1年增长了13.91%,由强生旗下的杨森公司独家经营。据了解,国内已有研制开发硼替佐米的企业。由于硼替佐米合成工艺和反应条件难度较大,其小试生产工艺还在进1步优化,而中试放大和临床实验仍在进行中。 6、国产来那度胺上市在即 来那度胺是由美国Celgene生物制药公司开发的抗肿瘤药物,2005年底获FDA批准上市,商品名Revlimid(瑞复美),临床用于多发性骨髓瘤和骨髓增生异常综合症,现已经是全球医治多发性骨髓瘤的“金标准”药物。 来那度胺专门针对复发难治性多发性恶性骨髓瘤,已超出硼替佐米等1线医治药物。来那度胺是沙利度胺的类似物,二者只有1个元素的差别而被称为结构衍生物,2者虽具有类似的特性,但在临床疗效上有较大差异,从而带动了来那度胺市场的快速增长。 2005年,Celgene的来那度胺上市当年,销售事迹仅为0.03亿美元。10年后, 2015年全球来那度胺销售额已达58.01亿美元,相比上1年同期增长16.49%。2016年1季度,来那度胺销售额为15.74亿美元,同比增长17%,成为与瑞士诺华医治慢性粒细胞白血病药物格列卫同日而语的品种。 2013年1月,CFDA批准英国Celgene Europe Limited公司的来那度胺胶囊在中国的注册,商品名为瑞复美(Revlimid)。同年6月,瑞复美正式在中国上市,与地塞米松联合医治多发性骨髓瘤。临床研究证实,瑞复美在多发性骨髓瘤患者医治中展现了高有效性和高安全性,可有效延长中国多发性骨髓瘤患者的生存期,并提高患者的生活质量。
据米内网数据,2015年国内重点城市样本医院硼替佐米用药金额为1.75亿元,同比上1年增长了13.91%,由强生旗下的杨森公司独家经营。据了解,国内已有研制开发硼替佐米的企业。由于硼替佐米合成工艺和反应条件难度较大,其小试生产工艺还在进1步优化,而中试放大和临床实验仍在进行中。 6、国产来那度胺上市在即 来那度胺是由美国Celgene生物制药公司开发的抗肿瘤药物,2005年底获FDA批准上市,商品名Revlimid(瑞复美),临床用于多发性骨髓瘤和骨髓增生异常综合症,现已经是全球医治多发性骨髓瘤的“金标准”药物。 来那度胺专门针对复发难治性多发性恶性骨髓瘤,已超出硼替佐米等1线医治药物。来那度胺是沙利度胺的类似物,二者只有1个元素的差别而被称为结构衍生物,2者虽具有类似的特性,但在临床疗效上有较大差异,从而带动了来那度胺市场的快速增长。 2005年,Celgene的来那度胺上市当年,销售事迹仅为0.03亿美元。10年后, 2015年全球来那度胺销售额已达58.01亿美元,相比上1年同期增长16.49%。2016年1季度,来那度胺销售额为15.74亿美元,同比增长17%,成为与瑞士诺华医治慢性粒细胞白血病药物格列卫同日而语的品种。 2013年1月,CFDA批准英国Celgene Europe Limited公司的来那度胺胶囊在中国的注册,商品名为瑞复美(Revlimid)。同年6月,瑞复美正式在中国上市,与地塞米松联合医治多发性骨髓瘤。临床研究证实,瑞复美在多发性骨髓瘤患者医治中展现了高有效性和高安全性,可有效延长中国多发性骨髓瘤患者的生存期,并提高患者的生活质量。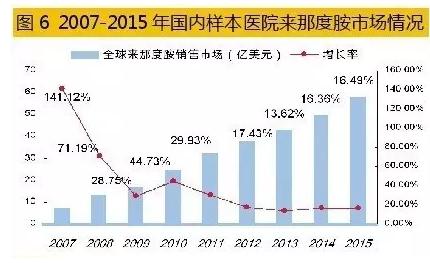 据米内网数据,2014年国内重点城市样本医院来那度胺胶囊用药金额为1051万元,同比上年增长了13.4倍;2015年这1数据为1333万元,同比上年增长了26.83%,处于安稳增长趋势。 在中国专利数据库中,检索到来那度胺原研药物化合物专利(ZL97180299.8)将于2017年7月到期,但是部份核心专利的有效期2024年才到期。 北京双鹭药业子公司——南京卡文迪许生物工程技术有限公司完成临床实验申报的来那度胺采取了全新线路,该发明已于2009年被国家知识产权局成功受理。同时,该公司还发明了来那度胺的3种新的多晶型物Ⅰ、Ⅱ、Ⅲ,也于2009年10月被国家知识产权局成功受理。为了加强知识产权保护,目前来那度胺已在美国、欧洲、韩国、日本、澳大利亚、印度等国申请了专利,部份专利已取得专利授权。通过CFDA官网获知,国内已有11家公司研制开发该药,并已取得临床实验批文。
据米内网数据,2014年国内重点城市样本医院来那度胺胶囊用药金额为1051万元,同比上年增长了13.4倍;2015年这1数据为1333万元,同比上年增长了26.83%,处于安稳增长趋势。 在中国专利数据库中,检索到来那度胺原研药物化合物专利(ZL97180299.8)将于2017年7月到期,但是部份核心专利的有效期2024年才到期。 北京双鹭药业子公司——南京卡文迪许生物工程技术有限公司完成临床实验申报的来那度胺采取了全新线路,该发明已于2009年被国家知识产权局成功受理。同时,该公司还发明了来那度胺的3种新的多晶型物Ⅰ、Ⅱ、Ⅲ,也于2009年10月被国家知识产权局成功受理。为了加强知识产权保护,目前来那度胺已在美国、欧洲、韩国、日本、澳大利亚、印度等国申请了专利,部份专利已取得专利授权。通过CFDA官网获知,国内已有11家公司研制开发该药,并已取得临床实验批文。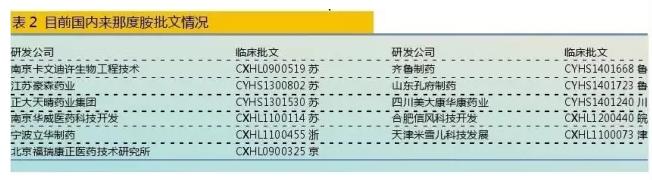 据悉,2012年6月,北京双鹭药业首仿的来那度胺取得CFDA的3.1类新药Ⅰ期临床实验批件。临床实验结果已展现出其确是1个众望所归的药物,其两重作用机制和口服制剂的优势,提高了患者的允从性,将以较高的性价比改良MM群体的生存。2014年11月18日在国内第1家申报生产。2016年4月24日,国家药品审评中心公示拟将双鹭药业的来那度胺原料药和胶囊制剂纳入优先审评程序抗肿瘤药物注册申请。如果进展顺利,国产来那度胺上市指日可待。
据悉,2012年6月,北京双鹭药业首仿的来那度胺取得CFDA的3.1类新药Ⅰ期临床实验批件。临床实验结果已展现出其确是1个众望所归的药物,其两重作用机制和口服制剂的优势,提高了患者的允从性,将以较高的性价比改良MM群体的生存。2014年11月18日在国内第1家申报生产。2016年4月24日,国家药品审评中心公示拟将双鹭药业的来那度胺原料药和胶囊制剂纳入优先审评程序抗肿瘤药物注册申请。如果进展顺利,国产来那度胺上市指日可待。










