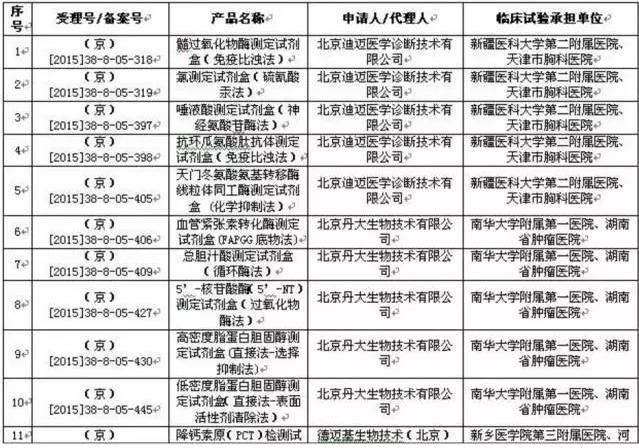

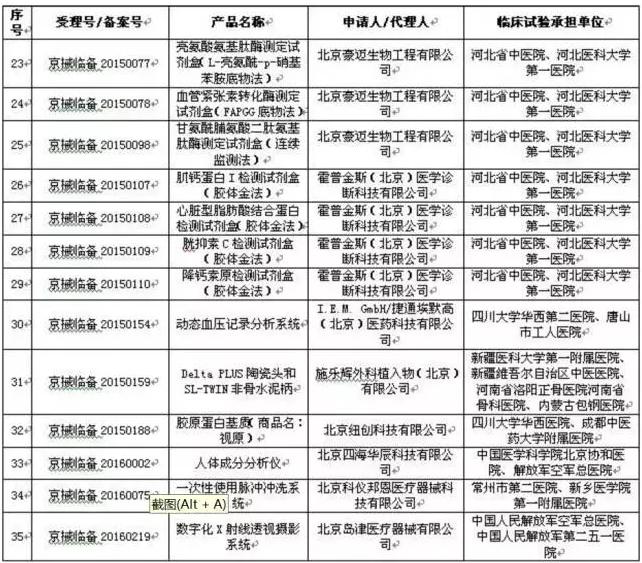

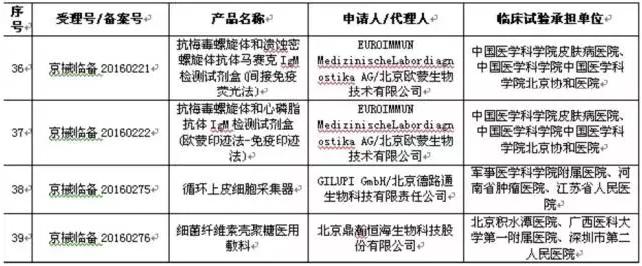
 12省开启医械临床数据核对,北京处罚较严 在地方,截至目前,已有北京、天津、山东、湖南、湖北、浙江、上海、江苏、广东、云南、广西、河南这12个省(直辖市、自治区)相继发布临床实验监督抽查工作文件。 而在对“存在临床实验数据真实性问题”的企业处罚上,北京的处罚也是相对较严的。 北京市规定: 在检查中发现临床实验数据不真实的,对在审的注册申请,作出不予注册决定; 已获得注册证书的,撤消原许可证件,并5年内不受理相干责任人及企业提出的医疗器械许可申请。 仅存在合规性问题的,对注册申请资料和监督检查发现的问题进行安全性和有效性综合评价,作出是不是批准注册的决定。
12省开启医械临床数据核对,北京处罚较严 在地方,截至目前,已有北京、天津、山东、湖南、湖北、浙江、上海、江苏、广东、云南、广西、河南这12个省(直辖市、自治区)相继发布临床实验监督抽查工作文件。 而在对“存在临床实验数据真实性问题”的企业处罚上,北京的处罚也是相对较严的。 北京市规定: 在检查中发现临床实验数据不真实的,对在审的注册申请,作出不予注册决定; 已获得注册证书的,撤消原许可证件,并5年内不受理相干责任人及企业提出的医疗器械许可申请。 仅存在合规性问题的,对注册申请资料和监督检查发现的问题进行安全性和有效性综合评价,作出是不是批准注册的决定。










