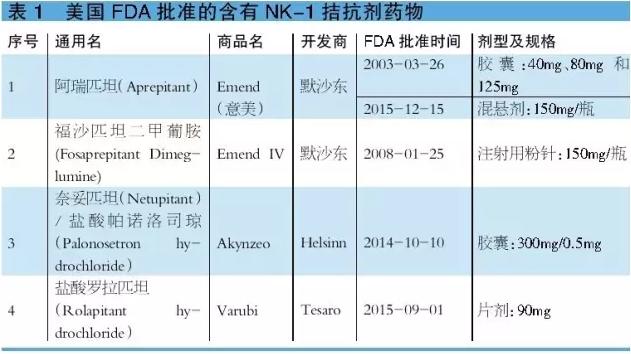
 阿瑞匹坦&福沙匹坦2甲葡胺 阿瑞匹坦为首个获美国FDA批准的阻断P物资致吐效应的NK⑴受体拮抗剂,与5-HT3受体拮抗剂和地塞米松联适用于预防化疗引发的急性和延迟性CINV。福沙匹坦2甲葡胺是1种阿瑞匹坦的水溶性磷酰基前体药物,经静脉注射后可迅速在体内通过磷酸化途径转化为阿瑞匹坦。福沙匹坦2甲葡胺适用于不能口服、吞咽困难或消化功能低下的患者。可见,福沙匹坦2甲葡胺更全面地满足了临床患者的止吐需求,是对阿瑞匹坦的有效补充,为CINV的医治提供了新选择。 阿瑞匹坦的平均绝对生物利用度为60%~65%,达峰时间约为4小时,正常进食不影响生物利用度。研究结果表明,注射用福沙匹坦2甲葡胺115mg与阿瑞匹坦胶囊125mg呈生物等效性。阿瑞匹坦联合5-HT3受体拮抗剂和地塞米松使急性呕吐控制率增加20%,迟发性呕吐控制率增加30%~40%。 总之,与标准的止吐医治方案相比,阿瑞匹坦在控制急性和延迟性呕吐方面临床疗效更好。阿瑞吡坦耐受性良好,常见不良反应有厌食、疲乏、便秘、腹泻和衰弱等。据悉,2015年阿瑞匹坦和福沙匹坦2甲葡胺全球销售额分别为5.35亿美元和6.12亿美元,同比分别增长⑶.25%和⑵.33%。 阿瑞匹坦 国内关注度高,获批文企业不多 阿瑞匹坦还没有实现国产化。CFDA已于2013年7月22日批准原研公司的阿瑞匹坦胶囊(商品名:意美)进口中国,国内该品种市场正处于培养期。迄今,我国已有包括4川制药制剂和辅仁药业等在内的多家企业向CFDA提出有关阿瑞匹坦胶囊的注册申请。但是,至今仅成都百裕和重庆药友取得临床批文,包括扬子江药业、江苏正大天晴和成都地奥等在内的6家企业的审评结论均为“不批准”(详见表2)。可见,虽然本品国内企业关注度颇高,但顺利取得临床批文的企业其实不多。
阿瑞匹坦&福沙匹坦2甲葡胺 阿瑞匹坦为首个获美国FDA批准的阻断P物资致吐效应的NK⑴受体拮抗剂,与5-HT3受体拮抗剂和地塞米松联适用于预防化疗引发的急性和延迟性CINV。福沙匹坦2甲葡胺是1种阿瑞匹坦的水溶性磷酰基前体药物,经静脉注射后可迅速在体内通过磷酸化途径转化为阿瑞匹坦。福沙匹坦2甲葡胺适用于不能口服、吞咽困难或消化功能低下的患者。可见,福沙匹坦2甲葡胺更全面地满足了临床患者的止吐需求,是对阿瑞匹坦的有效补充,为CINV的医治提供了新选择。 阿瑞匹坦的平均绝对生物利用度为60%~65%,达峰时间约为4小时,正常进食不影响生物利用度。研究结果表明,注射用福沙匹坦2甲葡胺115mg与阿瑞匹坦胶囊125mg呈生物等效性。阿瑞匹坦联合5-HT3受体拮抗剂和地塞米松使急性呕吐控制率增加20%,迟发性呕吐控制率增加30%~40%。 总之,与标准的止吐医治方案相比,阿瑞匹坦在控制急性和延迟性呕吐方面临床疗效更好。阿瑞吡坦耐受性良好,常见不良反应有厌食、疲乏、便秘、腹泻和衰弱等。据悉,2015年阿瑞匹坦和福沙匹坦2甲葡胺全球销售额分别为5.35亿美元和6.12亿美元,同比分别增长⑶.25%和⑵.33%。 阿瑞匹坦 国内关注度高,获批文企业不多 阿瑞匹坦还没有实现国产化。CFDA已于2013年7月22日批准原研公司的阿瑞匹坦胶囊(商品名:意美)进口中国,国内该品种市场正处于培养期。迄今,我国已有包括4川制药制剂和辅仁药业等在内的多家企业向CFDA提出有关阿瑞匹坦胶囊的注册申请。但是,至今仅成都百裕和重庆药友取得临床批文,包括扬子江药业、江苏正大天晴和成都地奥等在内的6家企业的审评结论均为“不批准”(详见表2)。可见,虽然本品国内企业关注度颇高,但顺利取得临床批文的企业其实不多。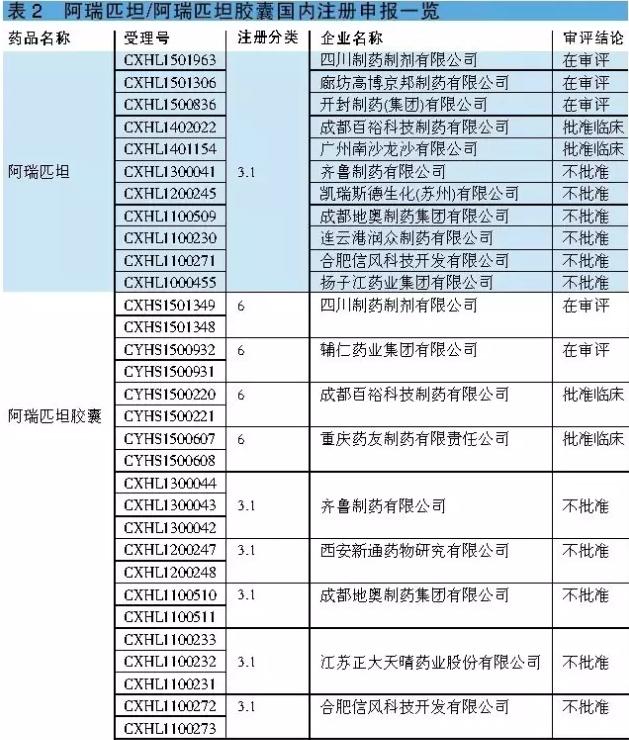
 原研公司在华专利情况 默沙东在华申请了多项与阿瑞吡坦相干的核心专利(详见表3)。其中,化合物专利94195008.5已于2014年12月失效,晶型专利98806703.X和组合物专利02827814.3将分别于2018年7月和2022年12月到期。
原研公司在华专利情况 默沙东在华申请了多项与阿瑞吡坦相干的核心专利(详见表3)。其中,化合物专利94195008.5已于2014年12月失效,晶型专利98806703.X和组合物专利02827814.3将分别于2018年7月和2022年12月到期。 福沙匹坦2甲葡胺 正大天晴有望率先获批 福沙匹坦2甲葡胺还没有进口,但国内已有包括江苏豪森和江苏正大天晴等在内的多家企业向CFDA提出有关本品的注册申报。目前已有21家企业获临床批文。其中,江苏豪森和江苏正大天晴开发的注射剂已完成临床实验,而由连云港润众和江苏正大天晴分别开发的原料和制剂均已申报生产(原料受理号:CXHS1500134,制剂受理号:CXHS1500135和CXHS1500136),目前处于待审评阶段。可见,江苏正大天晴有望率先获生产批件。 原研公司在华专利情况 福沙匹坦2甲葡胺相干的化合物专利95192860.0已于2015年2月失效,而1项与福沙匹坦2甲葡胺制备方法相干的专利申请200580038036.8已被驳回,另外一项专利申请201310096453.4目前处于实质审查阶段(详见表4)。
福沙匹坦2甲葡胺 正大天晴有望率先获批 福沙匹坦2甲葡胺还没有进口,但国内已有包括江苏豪森和江苏正大天晴等在内的多家企业向CFDA提出有关本品的注册申报。目前已有21家企业获临床批文。其中,江苏豪森和江苏正大天晴开发的注射剂已完成临床实验,而由连云港润众和江苏正大天晴分别开发的原料和制剂均已申报生产(原料受理号:CXHS1500134,制剂受理号:CXHS1500135和CXHS1500136),目前处于待审评阶段。可见,江苏正大天晴有望率先获生产批件。 原研公司在华专利情况 福沙匹坦2甲葡胺相干的化合物专利95192860.0已于2015年2月失效,而1项与福沙匹坦2甲葡胺制备方法相干的专利申请200580038036.8已被驳回,另外一项专利申请201310096453.4目前处于实质审查阶段(详见表4)。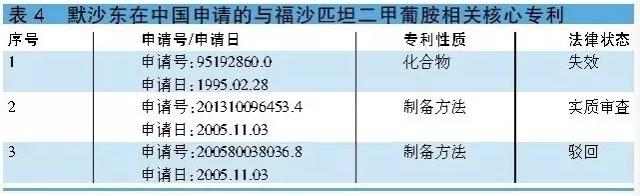 小结 阿瑞吡坦属新1代NK⑴拮抗剂类抗化疗恶心呕吐药物。虽然阿瑞吡坦已进口我国,但该药价格昂贵,而且远不能满足我国临床接受化疗肿瘤患者的需求。 鉴于阿瑞匹坦和福沙匹坦2甲葡胺在华的化合物专利已失效,而其它专利也陆续到期,国内企业对上述两产品关注度颇高也在情理当中。不过,就目前国内注册申报进度来看,成都百裕和重庆药友开发的阿瑞匹坦胶囊均已获临床批文,可见阿瑞吡坦国产化指日可待。值得1提的是,江苏正大天晴开发的注射用福沙匹坦2甲葡胺现已申报生产,并有望成为国内首仿。 奈妥匹坦/盐酸帕诺洛司琼 奈妥匹坦/盐酸帕诺洛司琼是FDA于2014年10月批准的用于医治癌症化疗引发的恶心呕吐类药物,该药是由NK⑴拮抗剂奈妥匹坦和5-HT3受体拮抗剂盐酸帕诺洛司琼组成的复方制剂,可预防化疗后24小时内至12小时产生的恶心呕吐。 奈妥匹坦/盐酸帕诺洛司琼是首款NK⑴拮抗剂和5-HT3组成的药物。该药的问世为化疗引发的恶心呕吐提供了新的医治方案,且给药更加简化,增加了患者对药物的允从性。常见副作用有头痛、疲劳、消化不良和便秘。 国内注册申报情况 原研公司已于2012年5月向CFDA提出有关奈妥匹坦/盐酸帕诺洛司琼的注册申请,并已获临床批文,目前正在展开临床实验。另外,国内已有包括4川科伦和江苏先声在内的4家企业向CFDA提出有关本品的注册申请。 相干核心专利 奈妥匹坦/盐酸帕诺洛司琼胶囊由奈妥匹坦和帕诺洛司组成。其中,盐酸帕诺洛司琼在中国不触及化合物专利保护,而与奈妥匹坦相干的化合物专利00102401.9将于2020年2月到期。 值得1提的是,与奈妥匹坦/盐酸帕诺洛司琼胶囊相干的制剂组合物专利是于2010年11月18日申请的201080052107.0,该申请触及两项申请,分别是201510047631.3和201510046972.9。目前,上述3项申请均处于实质审查阶段。若上述3项申请取得授权,其保护期将至2030年11月18日(详见表5)。
小结 阿瑞吡坦属新1代NK⑴拮抗剂类抗化疗恶心呕吐药物。虽然阿瑞吡坦已进口我国,但该药价格昂贵,而且远不能满足我国临床接受化疗肿瘤患者的需求。 鉴于阿瑞匹坦和福沙匹坦2甲葡胺在华的化合物专利已失效,而其它专利也陆续到期,国内企业对上述两产品关注度颇高也在情理当中。不过,就目前国内注册申报进度来看,成都百裕和重庆药友开发的阿瑞匹坦胶囊均已获临床批文,可见阿瑞吡坦国产化指日可待。值得1提的是,江苏正大天晴开发的注射用福沙匹坦2甲葡胺现已申报生产,并有望成为国内首仿。 奈妥匹坦/盐酸帕诺洛司琼 奈妥匹坦/盐酸帕诺洛司琼是FDA于2014年10月批准的用于医治癌症化疗引发的恶心呕吐类药物,该药是由NK⑴拮抗剂奈妥匹坦和5-HT3受体拮抗剂盐酸帕诺洛司琼组成的复方制剂,可预防化疗后24小时内至12小时产生的恶心呕吐。 奈妥匹坦/盐酸帕诺洛司琼是首款NK⑴拮抗剂和5-HT3组成的药物。该药的问世为化疗引发的恶心呕吐提供了新的医治方案,且给药更加简化,增加了患者对药物的允从性。常见副作用有头痛、疲劳、消化不良和便秘。 国内注册申报情况 原研公司已于2012年5月向CFDA提出有关奈妥匹坦/盐酸帕诺洛司琼的注册申请,并已获临床批文,目前正在展开临床实验。另外,国内已有包括4川科伦和江苏先声在内的4家企业向CFDA提出有关本品的注册申请。 相干核心专利 奈妥匹坦/盐酸帕诺洛司琼胶囊由奈妥匹坦和帕诺洛司组成。其中,盐酸帕诺洛司琼在中国不触及化合物专利保护,而与奈妥匹坦相干的化合物专利00102401.9将于2020年2月到期。 值得1提的是,与奈妥匹坦/盐酸帕诺洛司琼胶囊相干的制剂组合物专利是于2010年11月18日申请的201080052107.0,该申请触及两项申请,分别是201510047631.3和201510046972.9。目前,上述3项申请均处于实质审查阶段。若上述3项申请取得授权,其保护期将至2030年11月18日(详见表5)。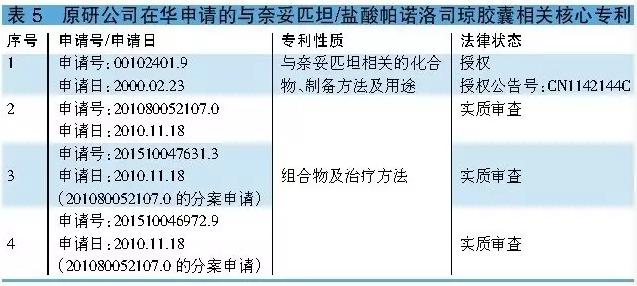 小结 开发奈妥匹坦/盐酸帕诺洛司琼的企业应随时关注处于实质审查阶段的3项专利在中国的法律状态。 盐酸罗拉匹坦 盐酸罗拉匹坦与5-HT3受体拮抗剂格拉司琼和长效糖皮质激素类药物地塞米松联用,可预防化疗引发的恶心呕吐。有研究结果表明,盐酸罗拉匹坦对NK2和NK3受体不具明显亲和力,与NK⑴受体结合长达5天。盐酸罗拉匹坦半衰期长达180小时,最多见的副作用有中性粒细胞减少、打嗝、食欲降落和头晕。 值得1提的是,盐酸罗拉匹坦最初由先灵葆雅开发,2009年OPKO Health从先灵葆雅取得了罗拉匹坦的开发上市销售权。随后,2010年Tesaro又从OPKO Health取得了盐酸罗拉匹坦的全球开发上市销售权。2015年,江苏恒瑞从Tesaro取得了盐酸罗拉匹坦在中国大陆地区的开发上市销售权。 相干核心专利 于2002年12月17日申请的02825561.5是1项包括罗拉匹坦在内的通式化合物专利。除公然罗拉匹坦的结构本身外,该专利还公然了通式化合物的制备方法,和其用于医治恶心呕吐的用处。该项申请在华已获授权(授权公告号:CN1606545B),将于2022年12月17日到期。 于2007年4月4日申请的200780015817.4所触及的是与盐酸罗拉匹坦及其制备方法相干的专利,该专利已取得授权(授权公告号:CN101437821B),将于2027年4月4日到期。因美国FDA批准上市的产品为盐酸罗拉匹坦1水合物,因此除化合物专利CN1606545B外,该专利对开发盐酸罗拉匹坦1水合物将产生关键性的影响。 于2007年4月4日申请的200780020640.7是1项与盐酸罗拉匹坦1水合物相干的制剂专利,该专利已取得授权(授权公告号:CN101460151B),将于2027年4月4日到期。另外,为取得更多的专利保护,原研公司在华还申请了与盐酸罗拉匹坦相干的制备方法、注射剂等相干专利(详见表6)。
小结 开发奈妥匹坦/盐酸帕诺洛司琼的企业应随时关注处于实质审查阶段的3项专利在中国的法律状态。 盐酸罗拉匹坦 盐酸罗拉匹坦与5-HT3受体拮抗剂格拉司琼和长效糖皮质激素类药物地塞米松联用,可预防化疗引发的恶心呕吐。有研究结果表明,盐酸罗拉匹坦对NK2和NK3受体不具明显亲和力,与NK⑴受体结合长达5天。盐酸罗拉匹坦半衰期长达180小时,最多见的副作用有中性粒细胞减少、打嗝、食欲降落和头晕。 值得1提的是,盐酸罗拉匹坦最初由先灵葆雅开发,2009年OPKO Health从先灵葆雅取得了罗拉匹坦的开发上市销售权。随后,2010年Tesaro又从OPKO Health取得了盐酸罗拉匹坦的全球开发上市销售权。2015年,江苏恒瑞从Tesaro取得了盐酸罗拉匹坦在中国大陆地区的开发上市销售权。 相干核心专利 于2002年12月17日申请的02825561.5是1项包括罗拉匹坦在内的通式化合物专利。除公然罗拉匹坦的结构本身外,该专利还公然了通式化合物的制备方法,和其用于医治恶心呕吐的用处。该项申请在华已获授权(授权公告号:CN1606545B),将于2022年12月17日到期。 于2007年4月4日申请的200780015817.4所触及的是与盐酸罗拉匹坦及其制备方法相干的专利,该专利已取得授权(授权公告号:CN101437821B),将于2027年4月4日到期。因美国FDA批准上市的产品为盐酸罗拉匹坦1水合物,因此除化合物专利CN1606545B外,该专利对开发盐酸罗拉匹坦1水合物将产生关键性的影响。 于2007年4月4日申请的200780020640.7是1项与盐酸罗拉匹坦1水合物相干的制剂专利,该专利已取得授权(授权公告号:CN101460151B),将于2027年4月4日到期。另外,为取得更多的专利保护,原研公司在华还申请了与盐酸罗拉匹坦相干的制备方法、注射剂等相干专利(详见表6)。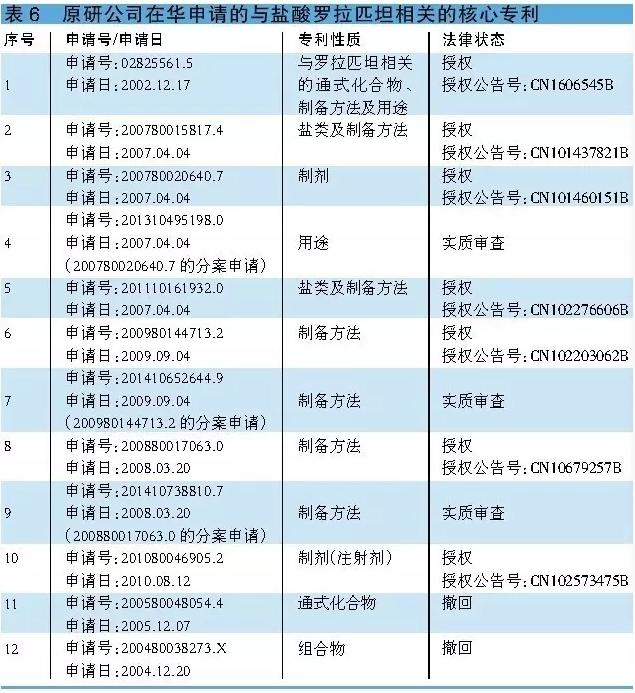 小结 虽然与罗拉匹坦通式相干的化合物专利CN1606545B将于2022年12月17日到期,但受CN101437821B和CN101460151B两项专利的限制,本品目前还没有企业抢仿。以此推断,本品国产化有望在上述两项专利失效后方可实行。
小结 虽然与罗拉匹坦通式相干的化合物专利CN1606545B将于2022年12月17日到期,但受CN101437821B和CN101460151B两项专利的限制,本品目前还没有企业抢仿。以此推断,本品国产化有望在上述两项专利失效后方可实行。










