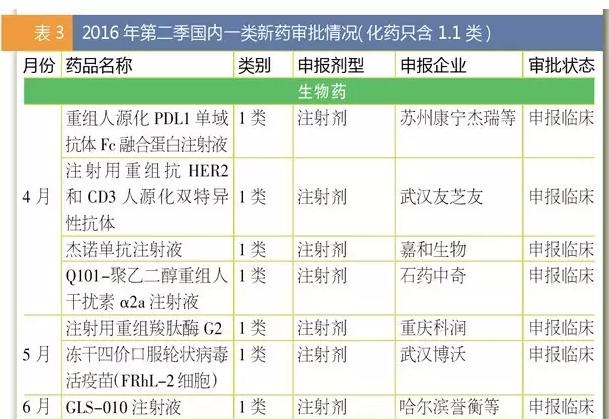
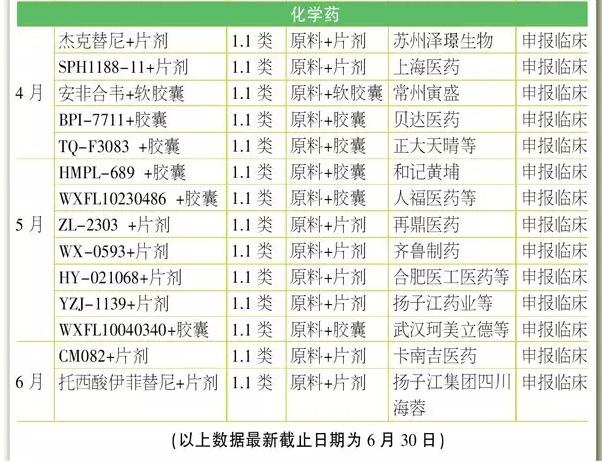
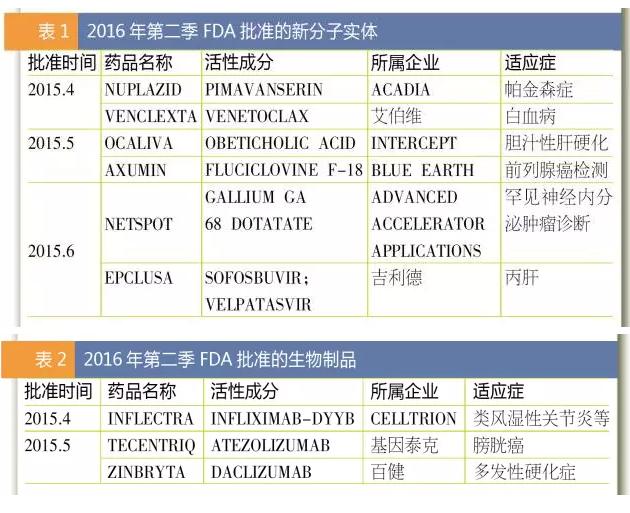
 5月18日,FDA批准了全球首个PD-L1抗体药物Tecentriq,作为2线药物医治1种叫做urothelial carcinoma的最多见晚期膀胱癌。同时,FDA也批准了PD-L1伴随诊断试剂SP142。这是30多年来FDA针对这1特定膀胱癌批准的首个新药,此药曾前后取得FDA的突破性疗法认定、优先审评资历和加速审批资历。业界预测Tecentriq的销售峰值将达25亿美元。 6月28日,FDA批准了吉祥德的又1抗丙肝药物Epclusa,它是FDA批准的首个用于所有6个主要基因亚型的抗丙肝药物。Epclusa是索非布韦和新药velpatasvir的固定复方组合,是吉祥德为了进1步巩固其抗丙肝领域霸主地位的又1“重磅炸弹”。虽然HCV不同的基因类型序列能相差30%,但Epclusa1概通吃,12周的延续病毒学应对率都超过95%。 4月5日,FDA批准了第2种在美国市场销售的生物类似药INFLECTRA,它是重磅药物Remicade(类克,infliximab)的生物类似药,由辉瑞和韩国生物制品制造商Celltrion共同开发。早在2013年,INFLECTRA就成为欧盟获批的首个单抗类生物类似药。有机构预测这些生物类似药将在未来几年为美国保险公司、医生和病人节省数10亿美元。 欧盟 [看点] 5个孤儿药(Idelvion、Alprolix、Darzalex、Strimvelis、Galafold)、第2个IL⑴7A单抗药TALTZ、更加灵活的生物类似药审批 欧盟2016年第2季(截至6月24日)批准了17个药物。 其中包括5个孤儿药,分别为医治血友病的Idelvion及Alprolix,医治多发性骨髓瘤的人源化抗CD38单抗Darzalex,儿童基因医治药物Strimvelis,和法布瑞氏症药物Galafold。 Galafold是去年秋季被FDA谢绝以后取得欧盟首肯。法布瑞氏症是X染色体缺点的遗传疾病,Galafold的获批将为此类患者带来新的用药选择。 Strimvelis是专用于ADA重症联合免疫缺点的患儿,它是世界上首个解救生命的儿童基因医治产品。Strimvelis不依赖于第3方捐献者,因此不存在因排挤(移植物抗宿主病)引发的免疫不相容风险。 单抗Darzalex在欧洲的获批晚于美国。美国于去年11月批准其上市,并兼具孤儿药和优先审评身份,是全球首个被批准用于医治多发性骨髓瘤的单克隆抗体。 Alprolix(重组凝血因子IX Fc融会蛋白),是第1款长效凝血因子疗法药物,于2014年获FDA批准,欧盟获批晚了两年。 用于医治儿童及成年血友病的长效重组白蛋白融会蛋白IDELVION,在欧盟获批时间则晚于FDA两个月。 第2季欧盟批准了4款单抗类产品。 其中礼来医治银屑病的TALTZ(ixekizumab)被业界寄与厚望。它是继诺华重磅抗炎药Cosentyx(secukinumab)以后,全球获批的第2款IL⑴7A单抗药物,业界预计其年销售峰值将突破10亿美元。 而继1月3星Bioepis依那西普生物类似药Benepali在欧盟获批以后,5月其抗炎药类克的生物类似药Flixabi再次取得批准,标志着其致力于高品质生物类似药开发取得良好的进展。 目前,3星Bioepis正在开发多个重磅品牌药的生物类似药,包括赛诺菲的重磅胰岛夙来得时、艾伯维的重磅抗炎药修美乐、罗氏的抗癌药赫赛汀和安维汀;另有7个份子处于初期临床开发阶段。 中国 [看点] 化药1.1类和生物药的1类新药申请数量减少;1.1类新药苹果酸奈诺沙星获批是亮点;关注“撤回申请”和“不批准” 1致性评价如火如荼地进行,使CDE和企业专注于已有产品的研究上,获批新批文固然只是意外的欣喜,数量不会太多。 从CFDA公布的月度药品批准上市情况来看,4月至6月,国内2季度共批准了38个药品上市。其中,4月25个,制剂批文仅8个;5月14个,制剂批文仅7个;6月5个批文,制剂批文3个。 唯1的亮点是5月的1.1类新药苹果酸奈诺沙星的获批,它是1款无氟喹诺酮药物,对许多耐药细菌如耐甲氧西林金黄色葡萄球菌、耐喹诺酮类金黄色葡萄球菌、耐喹诺酮类肺炎链球菌有效。 药物审评阶段方面,审批结论为“撤回申请”或“不批准”吸引了笔者的眼球。4月58个“撤回”+8个“不批准”占到总申请量的7.3%;5月15个“撤回”+4个“不批准”;6月5个“撤回”+1个“不批准”,这其中包括国内企业也包括外企。 而在新报注册方面,中药1类新药的新报数据依然为零;化药1.1类和生物药的1类新药申请数量与第1季相比均有明显降落。固然诸如美他非尼等数个1.1类新药也取得了CDE批准进行临床实验,但距离上市为时尚早。
5月18日,FDA批准了全球首个PD-L1抗体药物Tecentriq,作为2线药物医治1种叫做urothelial carcinoma的最多见晚期膀胱癌。同时,FDA也批准了PD-L1伴随诊断试剂SP142。这是30多年来FDA针对这1特定膀胱癌批准的首个新药,此药曾前后取得FDA的突破性疗法认定、优先审评资历和加速审批资历。业界预测Tecentriq的销售峰值将达25亿美元。 6月28日,FDA批准了吉祥德的又1抗丙肝药物Epclusa,它是FDA批准的首个用于所有6个主要基因亚型的抗丙肝药物。Epclusa是索非布韦和新药velpatasvir的固定复方组合,是吉祥德为了进1步巩固其抗丙肝领域霸主地位的又1“重磅炸弹”。虽然HCV不同的基因类型序列能相差30%,但Epclusa1概通吃,12周的延续病毒学应对率都超过95%。 4月5日,FDA批准了第2种在美国市场销售的生物类似药INFLECTRA,它是重磅药物Remicade(类克,infliximab)的生物类似药,由辉瑞和韩国生物制品制造商Celltrion共同开发。早在2013年,INFLECTRA就成为欧盟获批的首个单抗类生物类似药。有机构预测这些生物类似药将在未来几年为美国保险公司、医生和病人节省数10亿美元。 欧盟 [看点] 5个孤儿药(Idelvion、Alprolix、Darzalex、Strimvelis、Galafold)、第2个IL⑴7A单抗药TALTZ、更加灵活的生物类似药审批 欧盟2016年第2季(截至6月24日)批准了17个药物。 其中包括5个孤儿药,分别为医治血友病的Idelvion及Alprolix,医治多发性骨髓瘤的人源化抗CD38单抗Darzalex,儿童基因医治药物Strimvelis,和法布瑞氏症药物Galafold。 Galafold是去年秋季被FDA谢绝以后取得欧盟首肯。法布瑞氏症是X染色体缺点的遗传疾病,Galafold的获批将为此类患者带来新的用药选择。 Strimvelis是专用于ADA重症联合免疫缺点的患儿,它是世界上首个解救生命的儿童基因医治产品。Strimvelis不依赖于第3方捐献者,因此不存在因排挤(移植物抗宿主病)引发的免疫不相容风险。 单抗Darzalex在欧洲的获批晚于美国。美国于去年11月批准其上市,并兼具孤儿药和优先审评身份,是全球首个被批准用于医治多发性骨髓瘤的单克隆抗体。 Alprolix(重组凝血因子IX Fc融会蛋白),是第1款长效凝血因子疗法药物,于2014年获FDA批准,欧盟获批晚了两年。 用于医治儿童及成年血友病的长效重组白蛋白融会蛋白IDELVION,在欧盟获批时间则晚于FDA两个月。 第2季欧盟批准了4款单抗类产品。 其中礼来医治银屑病的TALTZ(ixekizumab)被业界寄与厚望。它是继诺华重磅抗炎药Cosentyx(secukinumab)以后,全球获批的第2款IL⑴7A单抗药物,业界预计其年销售峰值将突破10亿美元。 而继1月3星Bioepis依那西普生物类似药Benepali在欧盟获批以后,5月其抗炎药类克的生物类似药Flixabi再次取得批准,标志着其致力于高品质生物类似药开发取得良好的进展。 目前,3星Bioepis正在开发多个重磅品牌药的生物类似药,包括赛诺菲的重磅胰岛夙来得时、艾伯维的重磅抗炎药修美乐、罗氏的抗癌药赫赛汀和安维汀;另有7个份子处于初期临床开发阶段。 中国 [看点] 化药1.1类和生物药的1类新药申请数量减少;1.1类新药苹果酸奈诺沙星获批是亮点;关注“撤回申请”和“不批准” 1致性评价如火如荼地进行,使CDE和企业专注于已有产品的研究上,获批新批文固然只是意外的欣喜,数量不会太多。 从CFDA公布的月度药品批准上市情况来看,4月至6月,国内2季度共批准了38个药品上市。其中,4月25个,制剂批文仅8个;5月14个,制剂批文仅7个;6月5个批文,制剂批文3个。 唯1的亮点是5月的1.1类新药苹果酸奈诺沙星的获批,它是1款无氟喹诺酮药物,对许多耐药细菌如耐甲氧西林金黄色葡萄球菌、耐喹诺酮类金黄色葡萄球菌、耐喹诺酮类肺炎链球菌有效。 药物审评阶段方面,审批结论为“撤回申请”或“不批准”吸引了笔者的眼球。4月58个“撤回”+8个“不批准”占到总申请量的7.3%;5月15个“撤回”+4个“不批准”;6月5个“撤回”+1个“不批准”,这其中包括国内企业也包括外企。 而在新报注册方面,中药1类新药的新报数据依然为零;化药1.1类和生物药的1类新药申请数量与第1季相比均有明显降落。固然诸如美他非尼等数个1.1类新药也取得了CDE批准进行临床实验,但距离上市为时尚早。