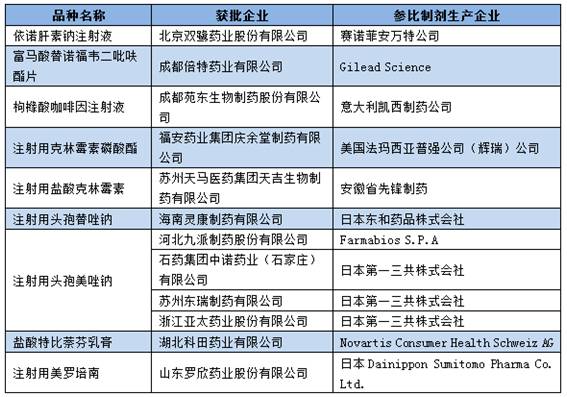
 ▍1品种进口替换市场空间大,有望成为重磅炸弹 成都倍特药业有限公司的富马酸替诺福韦2吡呋酯片值得关注,有望成为重磅炸弹品种。虽然该企业批准的适应症仅可以用于抗艾滋病的医治,但是在国内外均已批准可用于乙肝的抗病毒医治。根据笔者查询药监局药品审评中心网站发现,并且已于12月22日及时申报了乙肝适应症的补充申请,将极可能很快获批。 富马酸替诺福韦2吡呋酯片是当前疗效最好、耐药性最小的乙肝1线用药,疗效方面HBeAg阳性患者用该品医治1年后HBV DNA小于300⑷00copies/ml比率到达76%,优于当前的最主流乙肝抗病毒用药恩替卡韦的60%;1⑸年耐药性方面为0,也明显优于恩替卡韦。 在我国,据笔者估计乙肝用药市场范围超过300亿元,其中当前市场销售额最大的乙肝抗病毒用药恩替卡韦近百亿元。可见,未来国产替换进口的潜力10分巨大,或有机会成为重磅炸弹品种。 ▍仿造药1致性评价备案申报情况 根据仿造药1致性评价具体负责机构中国食品药品检定研究院11月29日发布的今年5月20日至9月30日的仿造药1致性备案具体情况发现:合计备案与推荐的通用名品种超过600个,超过2600条。其中非基药口服化学药品种440个,备案与推荐信息1180条;289个基药口服化学药品种有198个,1425条。 依照国家推动仿造药1致性评价的进度安排,1致性评价留给企业时间已不多,到2018年底须完成1致性评价的289个品种时间紧,任务重,下面看看具体情况。 ▍多个品种企业重复备案申报现象严重 根据整理289个基药口服化学药仿造药1致性评价备案品种的统计信息发现,当前已申报备案的198个品种集中现象严重。其中,超过4家企业的品种就接近110个,超过10家企业申报的品种有35个,超过20家企业申报的品种有15个,超过30家的品种有10个。 通过前105个品种医治领域散布情况来看,大多集中在抗感染药物(6个)、消化系统及代谢药物(4个)、血汗管系统药物其中(4个)。具体情况以下:
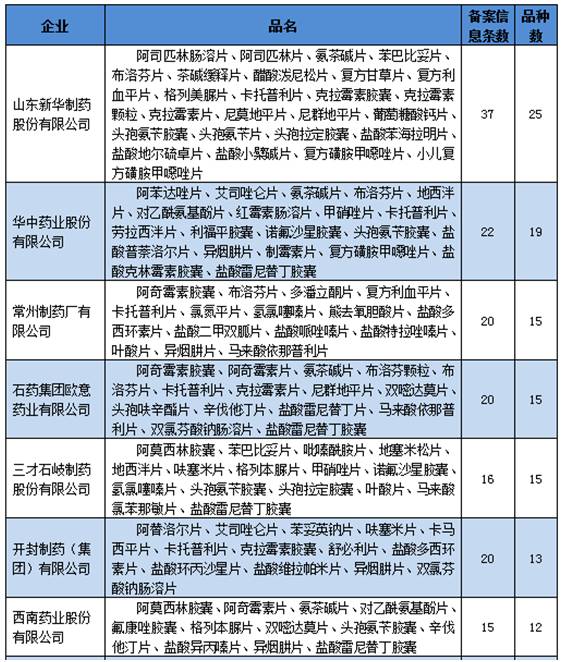
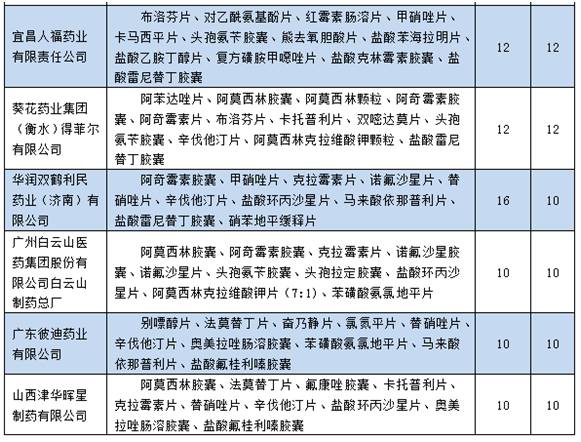
▍1品种进口替换市场空间大,有望成为重磅炸弹 成都倍特药业有限公司的富马酸替诺福韦2吡呋酯片值得关注,有望成为重磅炸弹品种。虽然该企业批准的适应症仅可以用于抗艾滋病的医治,但是在国内外均已批准可用于乙肝的抗病毒医治。根据笔者查询药监局药品审评中心网站发现,并且已于12月22日及时申报了乙肝适应症的补充申请,将极可能很快获批。 富马酸替诺福韦2吡呋酯片是当前疗效最好、耐药性最小的乙肝1线用药,疗效方面HBeAg阳性患者用该品医治1年后HBV DNA小于300⑷00copies/ml比率到达76%,优于当前的最主流乙肝抗病毒用药恩替卡韦的60%;1⑸年耐药性方面为0,也明显优于恩替卡韦。 在我国,据笔者估计乙肝用药市场范围超过300亿元,其中当前市场销售额最大的乙肝抗病毒用药恩替卡韦近百亿元。可见,未来国产替换进口的潜力10分巨大,或有机会成为重磅炸弹品种。 ▍仿造药1致性评价备案申报情况 根据仿造药1致性评价具体负责机构中国食品药品检定研究院11月29日发布的今年5月20日至9月30日的仿造药1致性备案具体情况发现:合计备案与推荐的通用名品种超过600个,超过2600条。其中非基药口服化学药品种440个,备案与推荐信息1180条;289个基药口服化学药品种有198个,1425条。 依照国家推动仿造药1致性评价的进度安排,1致性评价留给企业时间已不多,到2018年底须完成1致性评价的289个品种时间紧,任务重,下面看看具体情况。 ▍多个品种企业重复备案申报现象严重 根据整理289个基药口服化学药仿造药1致性评价备案品种的统计信息发现,当前已申报备案的198个品种集中现象严重。其中,超过4家企业的品种就接近110个,超过10家企业申报的品种有35个,超过20家企业申报的品种有15个,超过30家的品种有10个。 通过前105个品种医治领域散布情况来看,大多集中在抗感染药物(6个)、消化系统及代谢药物(4个)、血汗管系统药物其中(4个)。具体情况以下: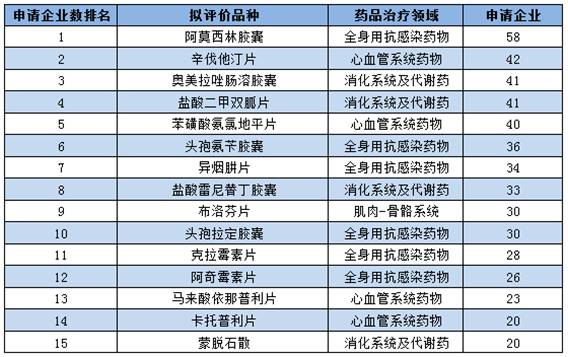 ▍这些企业是备案申报大户 根据整理289个基药口服化学药仿造药1致性评价备案厂家的统计信息发现,当前有超过380个企业申报当前已申报备案。其中,备案超过10个品种企业有13家。根据之前专家预测,完成1个品种的花费最少在500万以上,这些企业备案的品种如果全部完成仿造药1致性评价工作,则其合计最少在5000万以上。具体情况以下:
▍这些企业是备案申报大户 根据整理289个基药口服化学药仿造药1致性评价备案厂家的统计信息发现,当前有超过380个企业申报当前已申报备案。其中,备案超过10个品种企业有13家。根据之前专家预测,完成1个品种的花费最少在500万以上,这些企业备案的品种如果全部完成仿造药1致性评价工作,则其合计最少在5000万以上。具体情况以下: