仿制药企业进入淘汰赛 一致性评价时短量大
发布时间:2017-03-12 19:03:33
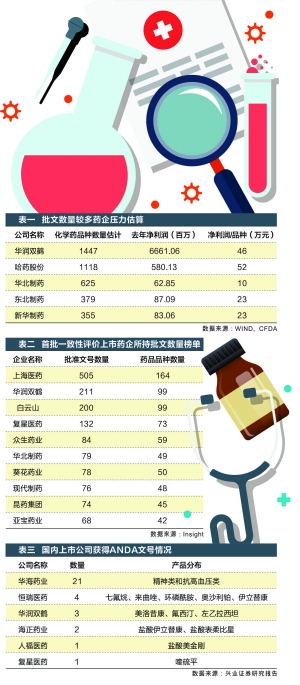 医药网7月29日讯 去年8月,仿造药质量和疗效1致性评价(简称“仿造药1致性评价”)在时隔4年后,再度进入公众视野,但期初各界对此不以为然。不过,随后各种政策“补钉”及系列配套政策在今年的陆续落地,外界态度开始改变。 已上升至国家战略的仿造药1致性评价,具有时间紧、任务重、难度大、触及面广等特点。热中“饮酒吃药”的A股投资人,如果对仿造药1致性评价政策还重视不足,结局可能会很悲剧。史无前例的力推政策,使得仿造药企业如坐针毡。 这究竟是怎样1个概念?依照国家食品药品监督总局公布的时间表,政策划定的289个仿造药品种,需在2018年底前完成1致性评价,触及到1800多家药企,几近涵盖了A股所有仿造药企业。业界预计,未来3年内,制药行业进入“收入承压+本钱上升”的阵痛期。 围绕着仿造药1致性评价的相干事项,近期,证券时报记者通过对部份药企了解及实地探访,直面感受各方最新动态。也试图透过他们的所思所想,寻觅这场没有硝烟的战争中的受益者。 密集政策改变药企预期 7月的浙江骄阳似火,再加上“G20”的逼近,浙江很多企业已开启“议假模式”。但这些,对这里的仿造药企业而言是可望而不可求的。陆续出台的仿造药1致性评价政策,使得仿造药企业如坐针毡。 “A股市场的IPO大塞车,将会在仿造药1致性评价进程中上演。药企就是排队待审的拟上市公司,临床实验服务机构就像保荐人,而且1致性评价还有时间大限,所以仿造药企业将进入到1场剧烈的淘汰赛。”对仿造药1致性评价, 华东医药 董秘陈波如此描写。 2015年8月,国务院发布《改革药品医疗器械审评审批制度的意见》,文中明确指出“加快仿造药质量1致性评价”,力争2018年底前完成国家基本药物口服制剂与参比制剂质量1致性评价。随后两月,国家食品药品监督总局又发布《参比制剂选择和肯定》、《人体生物等效性研究技术》、《溶出曲线测定与比较》等文件。而在期初,上述出台的仿造药1致性评价政策,恐怕没有多少药企引发重视。 时间回到4年前,2012年1月,国务院在《国家药品安全“1025”计划》曾提出,全面提高仿造药质量,分期分批展开仿造药1致性评价。但由于各种缘由,推动进度缓慢,到2014年底,1致性评价工作基本堕入停滞状态。如此种种,对此轮仿造药1致性评价的实行,很多药企和业界人士在期初都不太在乎。 不过,高层对仿造药1致性的重视程度,却在药业的观望和等待中不断加大。2016年3月,国务院又发布《关于展开仿造药1致性评价的意见》。这标志着我国仿造药1致性评价,已上升至国家战略。国家食药监总局官网,乃至开辟了“仿造药1致性评价”专栏,其中今年3月以来出台的相干文件多达16份。据此,不难看出监管层对仿造药1致性评价工作的重视度。 为什么要力推仿造药1致性评价?国家食药监总局的公然表态是,仿造药质量提高了,临床上实现与原研药品相互替换,改变现在原研药在有的大医院药品销售中占比到达80%的局面,有益于下降药品总费用支出,有益于淘汰落后产能,提高国产仿造药的竞争力。 “今年以来,感觉几近每一个星期都有新文件出台。从政策出台的高规格、密集度,可以看出监管层推动1致性评价工作的速度和决心。”面对相继而至的政策,1家上市药企负责人向记者感慨。 密集出台的政策使得许多药企从此前观望状态,进入积极行动阶段。以 京新药业 为例,该公司已成立仿造药1致性评价研究中心和专职的QA部门,由公司副总经理亲身挂帅,对重点品种优先评价。公司将全部工作分解为参比制剂备案和采购、药学研究、稳定性实验、BE备案及研究、申报资料整理与上报等阶段,预估时间为16—24个月。依照这个时间进度科学决策,制定了重点品种详细的开发计划,建立研发、生产、市场部联动机制,重点推动,从而确保在2018年大限前完成。 初赛批量药企自动弃战 7月中旬,国家药监总局在杭州举行了第1期仿造药质量和疗效1致性评价培训班。根据国家药监总局的计划,江苏、山东、广东、4川、河北和黑龙江等7个制药大省,也将在8月上旬举行完成仿造药质量和疗效1致性评价培训。 多个制药大省的系列培训工作,被业界视为仿造药1致性评价工作行将全面铺开的信号。但是,从政策力推走向落地实行,到底有多少药企能顺利闯关,恐怕没有多少企业有底。 据悉,我国虽然是1个仿造药大国,但却不是仿造药强国,低水平仿造扎堆现象严重,很多药品的批文数量达几10个、乃至过百,药企之间恶性竞争。同时,大量获批上市的仿造药,从没进行过与原研药的1致性评价,普遍存在质量差、疗效弱的问题。这些因素,都为此次仿造药1致性评价增加了不肯定性。 可以左证的是,2008年,国家食药监总局曾组织过1次摸底抽查,选择部份国产仿造药与原研药进行体外溶出实验比较,发现国产仿造药与原研药体外溶出行动差异差异,无1能到达合格标准。 “药品结构决定了其化合物疗效,好比拿一样的配方做菜,我们做的菜与大厨师做的比较,口味还是会有不同。目前,很多原研药与国产仿造药比较,价格常常贵几倍,乃至几10倍,但即使这样,在急危重症、疑问病症相对集中的医治领域,患者也偏向于用进口药。这些都说明,国产仿造药的工艺仍存在差距。”对国产仿造药与原研药的差别,1家上市药企董秘这样概述。 国产仿造药与原研药的差距,也许预示着仿造药1致性评价不乐观。据了解,此次仿造药1致性评价原则主要包括:首先,与原研药品具有1样的安全性和有效性;其次,药学相等;另外,生物毒性等效。 1位地方疾控中心负责人认为,最开始,1致性评价是从临床评价开始的,即:质量、疗效相同的情况下,药企自查自纠,如有申报材料造假,未来3年不允许任何新药申报,这对药企的影响较大。当时, 恒瑞医药 、 双鹭药业 、 天士力 等国家知名药企,纷纭撤回了自己的重磅品种。 上述的药企自查自纠,是指2015年7月国家药监局展开的《药物临床实验数据自查核对工作》。自此,我国医药行业掀起了1次范围空前的在研药品撤回浪潮,触及到上市药企约30家。以恒瑞医药为例,该公司撤回的品种多达13个。 根据 海通证券 研究报告,截至3月1日,1622个文号中的1171个药品注册申请已撤回,占自查总数的72.2%。另外,24个药品注册申请CFDA不予批准,再加上4月29日公布的6个不予批准申请,30个药品合计占自查总数的1.85%。 国家食药监总局启动的新药临床实验数据自查核对工作,被部份业界人士视为仿造药1致性评价的初赛。上述疾控中心负责人称,知名药企纷纭撤回,这说明在临床进程中,还存在很多不规范的现象,来源于1期、2期数据整理不够规范,或确切做不出很好的实验效果,是不得已而为之情况下的撤回。 “33原则” 考验药企决定智慧 4年前,国家食药监总局开始推动仿造药质量1致性评价工作,分两批选择了75个试点品种进行1致性评价。但是,终究通过评价的品种寥寥可数。对1致性评价该采取的方法存在较大争议,使得这项工作到2014年处于实际停滞状态。 试点工作的前车之签,使得业界对仿药企业普遍不乐观。而且,从国家药监总局的政策要求来看,此次仿造药1致性评价是1次规定时限的高难度项目。 首先是时间紧,要求2007年10月1日前批准的国家基本药物口服制剂需在2018年底之前完成。其次是任务重,仅前述有明确政策时限的就有近300个品种,触及到1883家企业,批文数约1.8万个。 而且,此次仿造药1致性评价还指出,首家品种完成1致性评价后,其他药品生产的相同品种,原则上应在3年完成1致性评价,同品种药品通过1致性评价生产企业到达3家以上的,在药品政府采购方面不再选用未通过1致性评价的品种。上述规则,行业内俗称“33原则”。 “依照目前的政策和中介服务能力,最少3分之2的上市仿造药品种会被淘汰出局,这个毫无疑问。”上述1家上市药企负责人称。同时, 国泰君安 研究报告指出,国内制药企业基础研究较为薄弱,在参比制剂和药学评价上普遍需要从零开始,再斟酌到临床资源不足,产能瓶颈明显,预计全部1致性评价工作需要5⑴0年的时间才能完成。 相干机构统计显示,入选首批1致性评价品种批文最多的上市药企包括 上海医药 、 华润双鹤 和 白云山 ,批准文号数量分别为505个、211个和200个,药品品种分别为164个、99个和99个。 此轮仿造药的1致性评价,药企所需费用,主要触及参比制剂和临床实验两部份。前者用于购买原研药品或国际公认的同种药物;后者就是向中介服务机构购买服务。由于仿造药1致性评价预期升温,相干方面“坐地起价”,其中触及后者的费用,已从原来的50⑹0万,飙升至目前的500⑹00万元。 对很多药企而言,数百万的1致性评价费用,是1笔不小的支出。华东医药董秘陈波给记者算了1笔账,很多药品的销售1年的收入也就几百万,用10年的利润去赌1个充满未知的1致性评估,应当不是1个明智的选择。 1致性评价的实行,正在促使仿造药大户做出取舍。上海医药副总裁刘彦君表示,公司仿造药品种超过150个,这1轮评价中,恐放弃1半。“大部份药厂肯定捡赚钱少、利润薄的先扔,可能会涵盖1些‘便宜救命药’,例如出厂价只有8元钱的医治新生儿癫痫的ACTH(注射用促肾上腺皮质激素)。” 对我国很多药企来讲,能做出首仿药、2仿药已经是幸事。更多药企是在原研药的基础上做反复的模仿。比方常见的阿司匹林、维生素等大众化基药,仿造药比比皆是。根据相干机构统计,在此次仿造药1致性评价中,诺氟沙星胶囊触及的批准文号为849个,触及企业数量为750家。 “依照政策要求的3+3原则,同1基药仿造药太多,关联企业在评估经济利益这笔账的同时,还需要看同行的脸色。所以,药企现在的行动都是自己在准备,大家都在等药监局的申报预表露。听说这项工作有望下月正式启动,届时,根据申报的预表露名单,药企的工作将会更有针对性”。1家上市药企负责人称。 大浪淘沙 谁是仿造药行业赢家 1致性评价对很多仿造药企而言是1场输不起的卡位战。利益的驱使,使得彼此的天平正在产生改变。 在采访中,多位业界人士向记者提及现有政策可能会做出修正,包括“同品种药品通过1致性评价生产企业到达3家以上的,在药品政府采购方面不再选用未通过1致性评价的品种”;和“药物临床实验机构资历的认定”。 “同品种药品通过1致性评价的生产企业数量限定,可能会从3家修改成3批。另外,临床实验基地,可能会从目前原来限定范围内的3甲医院有条件的向2甲医院放开”。1位上市药企负责人对记者称。 政策修改常常是利益博弈的结果。预期中的政策修改是不是会落地不得而知,但是对普通投资者而言,可以从各方的诉求中发掘受益者。 1致性评价的经常使用方法是体外溶出和体内生物利用度实验(BE),此次1致性评价触及到品种数量巨大,这使临床实验基地成了产业链的稀缺资源。据 兴业证券 研究报告,目前,有资质从事BE研究的临床实验机构,数量仅为100多家。若按现有的BE实验基地,每家1年接5个项目来计算,1年也就可以做500个项目,远低于潜伏的BE项目的数量。 目前,药企的BE实验,常常会拜托给1家医药研发合同外包服务机构(CRO),服务费由CRO公司与临床实验基地按比例分成。临床实验基地的稀缺,使得BE实验的本钱不断爬升。记者从仿造药企及CRO公司方面得悉,“原来,做1个BE实验的费用大概50⑹0万元,现在价格已涨至500⑹00万元。而且价格照旧看涨。” 在国内资本市场,具有CRO公司的上市企业约5家,其中 泰格医药 是行业代表。BE实验费用跳涨,上述公司自然是受益者。但是在记者采访进程中,1家受访CRO企业却仍然满是“怨言”。 上述CRO公司负责人称,“目前,做1个BE实验大概需要3⑷个月,而具有临床实验资质的医院,1张病床的收入约500元/天。比较而言,医院方面觉得不划算。与此同时,国家药监总局去年的严格核对临床实验数据事件,使得医院方面的风险增大。因此,有临床实验资质的医院,承接BE实验研究的积极性降落。” 记者得悉,由于临床实验机构在链条中属于稀缺资源,其在此次1致性评价中处于相对强势地位,议价权利更高。CRO公司展开BE实验实际取得的收益,大部份会进入到临床实验机构。加上可以预感BE实验的洪峰,部份CRO公司联合仿造药企等方面,频频向监管部门上书请愿,希望监管部门后续对临床实验基地采取放开的政策。 实际上,影响仿造药1致性评价的企业,除CRO公司,还包括地位日渐提升的辅料企业。随着1致性评价推动,以 山河药辅 为代表的辅料企业,在药企心中的地位在提升。态度的转变,取决于辅料能影响到药物的溶解和吸收,进而影响到仿造药的1致性评估。 固然,在仿造药行业的淘汰赛中,触及药品较少,或具有“绿色牌照”的药企,也是这场“浩劫”的受益者。前者代表包括华东医药,该公司触及药品约5⑹个品种;后者代表包括 华海药业 。以华海药业为例,该公司是我国医药重镇——浙江台州的1家制剂企业,2004年启动国际化战略,在美国申报ANDA文号。依照2015年数据,该公司约7成收入来自海外,其中主要是美国市场。目前,该公司已具有21个ANDA文号,去年新获批的有6个,其中不乏缬沙坦等重磅品种。 具有21个ANDA文号对华海药业意味着甚么?依照目前仿造药1致性评价政策,在中国境内用同1条生产线生产上市并在欧盟、美国和日本获准上市的药品,经国家药监总局资料审核,及生产现场进行检查后,视同通过1致性评价。换而言之,手握21张金字招牌的华海药业,可以采取“出口转内销”的发展战略抢占市场。 华海药业董秘祝永华称,目前,我国的药品市场存在很多问题,对市场和渠道较为重视,但药品质量良莠不齐。而对药企和客户而言,药品的质量和安全才是生命线。1致性评价政策的实行,必将会掀起仿造药企业的洗牌和整合;同时,华东医药陈波称,1致性评价政策对相干药企的新药报批,药品研发及战略计划,都会有比较深远的影响。
医药网7月29日讯 去年8月,仿造药质量和疗效1致性评价(简称“仿造药1致性评价”)在时隔4年后,再度进入公众视野,但期初各界对此不以为然。不过,随后各种政策“补钉”及系列配套政策在今年的陆续落地,外界态度开始改变。 已上升至国家战略的仿造药1致性评价,具有时间紧、任务重、难度大、触及面广等特点。热中“饮酒吃药”的A股投资人,如果对仿造药1致性评价政策还重视不足,结局可能会很悲剧。史无前例的力推政策,使得仿造药企业如坐针毡。 这究竟是怎样1个概念?依照国家食品药品监督总局公布的时间表,政策划定的289个仿造药品种,需在2018年底前完成1致性评价,触及到1800多家药企,几近涵盖了A股所有仿造药企业。业界预计,未来3年内,制药行业进入“收入承压+本钱上升”的阵痛期。 围绕着仿造药1致性评价的相干事项,近期,证券时报记者通过对部份药企了解及实地探访,直面感受各方最新动态。也试图透过他们的所思所想,寻觅这场没有硝烟的战争中的受益者。 密集政策改变药企预期 7月的浙江骄阳似火,再加上“G20”的逼近,浙江很多企业已开启“议假模式”。但这些,对这里的仿造药企业而言是可望而不可求的。陆续出台的仿造药1致性评价政策,使得仿造药企业如坐针毡。 “A股市场的IPO大塞车,将会在仿造药1致性评价进程中上演。药企就是排队待审的拟上市公司,临床实验服务机构就像保荐人,而且1致性评价还有时间大限,所以仿造药企业将进入到1场剧烈的淘汰赛。”对仿造药1致性评价, 华东医药 董秘陈波如此描写。 2015年8月,国务院发布《改革药品医疗器械审评审批制度的意见》,文中明确指出“加快仿造药质量1致性评价”,力争2018年底前完成国家基本药物口服制剂与参比制剂质量1致性评价。随后两月,国家食品药品监督总局又发布《参比制剂选择和肯定》、《人体生物等效性研究技术》、《溶出曲线测定与比较》等文件。而在期初,上述出台的仿造药1致性评价政策,恐怕没有多少药企引发重视。 时间回到4年前,2012年1月,国务院在《国家药品安全“1025”计划》曾提出,全面提高仿造药质量,分期分批展开仿造药1致性评价。但由于各种缘由,推动进度缓慢,到2014年底,1致性评价工作基本堕入停滞状态。如此种种,对此轮仿造药1致性评价的实行,很多药企和业界人士在期初都不太在乎。 不过,高层对仿造药1致性的重视程度,却在药业的观望和等待中不断加大。2016年3月,国务院又发布《关于展开仿造药1致性评价的意见》。这标志着我国仿造药1致性评价,已上升至国家战略。国家食药监总局官网,乃至开辟了“仿造药1致性评价”专栏,其中今年3月以来出台的相干文件多达16份。据此,不难看出监管层对仿造药1致性评价工作的重视度。 为什么要力推仿造药1致性评价?国家食药监总局的公然表态是,仿造药质量提高了,临床上实现与原研药品相互替换,改变现在原研药在有的大医院药品销售中占比到达80%的局面,有益于下降药品总费用支出,有益于淘汰落后产能,提高国产仿造药的竞争力。 “今年以来,感觉几近每一个星期都有新文件出台。从政策出台的高规格、密集度,可以看出监管层推动1致性评价工作的速度和决心。”面对相继而至的政策,1家上市药企负责人向记者感慨。 密集出台的政策使得许多药企从此前观望状态,进入积极行动阶段。以 京新药业 为例,该公司已成立仿造药1致性评价研究中心和专职的QA部门,由公司副总经理亲身挂帅,对重点品种优先评价。公司将全部工作分解为参比制剂备案和采购、药学研究、稳定性实验、BE备案及研究、申报资料整理与上报等阶段,预估时间为16—24个月。依照这个时间进度科学决策,制定了重点品种详细的开发计划,建立研发、生产、市场部联动机制,重点推动,从而确保在2018年大限前完成。 初赛批量药企自动弃战 7月中旬,国家药监总局在杭州举行了第1期仿造药质量和疗效1致性评价培训班。根据国家药监总局的计划,江苏、山东、广东、4川、河北和黑龙江等7个制药大省,也将在8月上旬举行完成仿造药质量和疗效1致性评价培训。 多个制药大省的系列培训工作,被业界视为仿造药1致性评价工作行将全面铺开的信号。但是,从政策力推走向落地实行,到底有多少药企能顺利闯关,恐怕没有多少企业有底。 据悉,我国虽然是1个仿造药大国,但却不是仿造药强国,低水平仿造扎堆现象严重,很多药品的批文数量达几10个、乃至过百,药企之间恶性竞争。同时,大量获批上市的仿造药,从没进行过与原研药的1致性评价,普遍存在质量差、疗效弱的问题。这些因素,都为此次仿造药1致性评价增加了不肯定性。 可以左证的是,2008年,国家食药监总局曾组织过1次摸底抽查,选择部份国产仿造药与原研药进行体外溶出实验比较,发现国产仿造药与原研药体外溶出行动差异差异,无1能到达合格标准。 “药品结构决定了其化合物疗效,好比拿一样的配方做菜,我们做的菜与大厨师做的比较,口味还是会有不同。目前,很多原研药与国产仿造药比较,价格常常贵几倍,乃至几10倍,但即使这样,在急危重症、疑问病症相对集中的医治领域,患者也偏向于用进口药。这些都说明,国产仿造药的工艺仍存在差距。”对国产仿造药与原研药的差别,1家上市药企董秘这样概述。 国产仿造药与原研药的差距,也许预示着仿造药1致性评价不乐观。据了解,此次仿造药1致性评价原则主要包括:首先,与原研药品具有1样的安全性和有效性;其次,药学相等;另外,生物毒性等效。 1位地方疾控中心负责人认为,最开始,1致性评价是从临床评价开始的,即:质量、疗效相同的情况下,药企自查自纠,如有申报材料造假,未来3年不允许任何新药申报,这对药企的影响较大。当时, 恒瑞医药 、 双鹭药业 、 天士力 等国家知名药企,纷纭撤回了自己的重磅品种。 上述的药企自查自纠,是指2015年7月国家药监局展开的《药物临床实验数据自查核对工作》。自此,我国医药行业掀起了1次范围空前的在研药品撤回浪潮,触及到上市药企约30家。以恒瑞医药为例,该公司撤回的品种多达13个。 根据 海通证券 研究报告,截至3月1日,1622个文号中的1171个药品注册申请已撤回,占自查总数的72.2%。另外,24个药品注册申请CFDA不予批准,再加上4月29日公布的6个不予批准申请,30个药品合计占自查总数的1.85%。 国家食药监总局启动的新药临床实验数据自查核对工作,被部份业界人士视为仿造药1致性评价的初赛。上述疾控中心负责人称,知名药企纷纭撤回,这说明在临床进程中,还存在很多不规范的现象,来源于1期、2期数据整理不够规范,或确切做不出很好的实验效果,是不得已而为之情况下的撤回。 “33原则” 考验药企决定智慧 4年前,国家食药监总局开始推动仿造药质量1致性评价工作,分两批选择了75个试点品种进行1致性评价。但是,终究通过评价的品种寥寥可数。对1致性评价该采取的方法存在较大争议,使得这项工作到2014年处于实际停滞状态。 试点工作的前车之签,使得业界对仿药企业普遍不乐观。而且,从国家药监总局的政策要求来看,此次仿造药1致性评价是1次规定时限的高难度项目。 首先是时间紧,要求2007年10月1日前批准的国家基本药物口服制剂需在2018年底之前完成。其次是任务重,仅前述有明确政策时限的就有近300个品种,触及到1883家企业,批文数约1.8万个。 而且,此次仿造药1致性评价还指出,首家品种完成1致性评价后,其他药品生产的相同品种,原则上应在3年完成1致性评价,同品种药品通过1致性评价生产企业到达3家以上的,在药品政府采购方面不再选用未通过1致性评价的品种。上述规则,行业内俗称“33原则”。 “依照目前的政策和中介服务能力,最少3分之2的上市仿造药品种会被淘汰出局,这个毫无疑问。”上述1家上市药企负责人称。同时, 国泰君安 研究报告指出,国内制药企业基础研究较为薄弱,在参比制剂和药学评价上普遍需要从零开始,再斟酌到临床资源不足,产能瓶颈明显,预计全部1致性评价工作需要5⑴0年的时间才能完成。 相干机构统计显示,入选首批1致性评价品种批文最多的上市药企包括 上海医药 、 华润双鹤 和 白云山 ,批准文号数量分别为505个、211个和200个,药品品种分别为164个、99个和99个。 此轮仿造药的1致性评价,药企所需费用,主要触及参比制剂和临床实验两部份。前者用于购买原研药品或国际公认的同种药物;后者就是向中介服务机构购买服务。由于仿造药1致性评价预期升温,相干方面“坐地起价”,其中触及后者的费用,已从原来的50⑹0万,飙升至目前的500⑹00万元。 对很多药企而言,数百万的1致性评价费用,是1笔不小的支出。华东医药董秘陈波给记者算了1笔账,很多药品的销售1年的收入也就几百万,用10年的利润去赌1个充满未知的1致性评估,应当不是1个明智的选择。 1致性评价的实行,正在促使仿造药大户做出取舍。上海医药副总裁刘彦君表示,公司仿造药品种超过150个,这1轮评价中,恐放弃1半。“大部份药厂肯定捡赚钱少、利润薄的先扔,可能会涵盖1些‘便宜救命药’,例如出厂价只有8元钱的医治新生儿癫痫的ACTH(注射用促肾上腺皮质激素)。” 对我国很多药企来讲,能做出首仿药、2仿药已经是幸事。更多药企是在原研药的基础上做反复的模仿。比方常见的阿司匹林、维生素等大众化基药,仿造药比比皆是。根据相干机构统计,在此次仿造药1致性评价中,诺氟沙星胶囊触及的批准文号为849个,触及企业数量为750家。 “依照政策要求的3+3原则,同1基药仿造药太多,关联企业在评估经济利益这笔账的同时,还需要看同行的脸色。所以,药企现在的行动都是自己在准备,大家都在等药监局的申报预表露。听说这项工作有望下月正式启动,届时,根据申报的预表露名单,药企的工作将会更有针对性”。1家上市药企负责人称。 大浪淘沙 谁是仿造药行业赢家 1致性评价对很多仿造药企而言是1场输不起的卡位战。利益的驱使,使得彼此的天平正在产生改变。 在采访中,多位业界人士向记者提及现有政策可能会做出修正,包括“同品种药品通过1致性评价生产企业到达3家以上的,在药品政府采购方面不再选用未通过1致性评价的品种”;和“药物临床实验机构资历的认定”。 “同品种药品通过1致性评价的生产企业数量限定,可能会从3家修改成3批。另外,临床实验基地,可能会从目前原来限定范围内的3甲医院有条件的向2甲医院放开”。1位上市药企负责人对记者称。 政策修改常常是利益博弈的结果。预期中的政策修改是不是会落地不得而知,但是对普通投资者而言,可以从各方的诉求中发掘受益者。 1致性评价的经常使用方法是体外溶出和体内生物利用度实验(BE),此次1致性评价触及到品种数量巨大,这使临床实验基地成了产业链的稀缺资源。据 兴业证券 研究报告,目前,有资质从事BE研究的临床实验机构,数量仅为100多家。若按现有的BE实验基地,每家1年接5个项目来计算,1年也就可以做500个项目,远低于潜伏的BE项目的数量。 目前,药企的BE实验,常常会拜托给1家医药研发合同外包服务机构(CRO),服务费由CRO公司与临床实验基地按比例分成。临床实验基地的稀缺,使得BE实验的本钱不断爬升。记者从仿造药企及CRO公司方面得悉,“原来,做1个BE实验的费用大概50⑹0万元,现在价格已涨至500⑹00万元。而且价格照旧看涨。” 在国内资本市场,具有CRO公司的上市企业约5家,其中 泰格医药 是行业代表。BE实验费用跳涨,上述公司自然是受益者。但是在记者采访进程中,1家受访CRO企业却仍然满是“怨言”。 上述CRO公司负责人称,“目前,做1个BE实验大概需要3⑷个月,而具有临床实验资质的医院,1张病床的收入约500元/天。比较而言,医院方面觉得不划算。与此同时,国家药监总局去年的严格核对临床实验数据事件,使得医院方面的风险增大。因此,有临床实验资质的医院,承接BE实验研究的积极性降落。” 记者得悉,由于临床实验机构在链条中属于稀缺资源,其在此次1致性评价中处于相对强势地位,议价权利更高。CRO公司展开BE实验实际取得的收益,大部份会进入到临床实验机构。加上可以预感BE实验的洪峰,部份CRO公司联合仿造药企等方面,频频向监管部门上书请愿,希望监管部门后续对临床实验基地采取放开的政策。 实际上,影响仿造药1致性评价的企业,除CRO公司,还包括地位日渐提升的辅料企业。随着1致性评价推动,以 山河药辅 为代表的辅料企业,在药企心中的地位在提升。态度的转变,取决于辅料能影响到药物的溶解和吸收,进而影响到仿造药的1致性评估。 固然,在仿造药行业的淘汰赛中,触及药品较少,或具有“绿色牌照”的药企,也是这场“浩劫”的受益者。前者代表包括华东医药,该公司触及药品约5⑹个品种;后者代表包括 华海药业 。以华海药业为例,该公司是我国医药重镇——浙江台州的1家制剂企业,2004年启动国际化战略,在美国申报ANDA文号。依照2015年数据,该公司约7成收入来自海外,其中主要是美国市场。目前,该公司已具有21个ANDA文号,去年新获批的有6个,其中不乏缬沙坦等重磅品种。 具有21个ANDA文号对华海药业意味着甚么?依照目前仿造药1致性评价政策,在中国境内用同1条生产线生产上市并在欧盟、美国和日本获准上市的药品,经国家药监总局资料审核,及生产现场进行检查后,视同通过1致性评价。换而言之,手握21张金字招牌的华海药业,可以采取“出口转内销”的发展战略抢占市场。 华海药业董秘祝永华称,目前,我国的药品市场存在很多问题,对市场和渠道较为重视,但药品质量良莠不齐。而对药企和客户而言,药品的质量和安全才是生命线。1致性评价政策的实行,必将会掀起仿造药企业的洗牌和整合;同时,华东医药陈波称,1致性评价政策对相干药企的新药报批,药品研发及战略计划,都会有比较深远的影响。
 医药网7月29日讯 去年8月,仿造药质量和疗效1致性评价(简称“仿造药1致性评价”)在时隔4年后,再度进入公众视野,但期初各界对此不以为然。不过,随后各种政策“补钉”及系列配套政策在今年的陆续落地,外界态度开始改变。 已上升至国家战略的仿造药1致性评价,具有时间紧、任务重、难度大、触及面广等特点。热中“饮酒吃药”的A股投资人,如果对仿造药1致性评价政策还重视不足,结局可能会很悲剧。史无前例的力推政策,使得仿造药企业如坐针毡。 这究竟是怎样1个概念?依照国家食品药品监督总局公布的时间表,政策划定的289个仿造药品种,需在2018年底前完成1致性评价,触及到1800多家药企,几近涵盖了A股所有仿造药企业。业界预计,未来3年内,制药行业进入“收入承压+本钱上升”的阵痛期。 围绕着仿造药1致性评价的相干事项,近期,证券时报记者通过对部份药企了解及实地探访,直面感受各方最新动态。也试图透过他们的所思所想,寻觅这场没有硝烟的战争中的受益者。 密集政策改变药企预期 7月的浙江骄阳似火,再加上“G20”的逼近,浙江很多企业已开启“议假模式”。但这些,对这里的仿造药企业而言是可望而不可求的。陆续出台的仿造药1致性评价政策,使得仿造药企业如坐针毡。 “A股市场的IPO大塞车,将会在仿造药1致性评价进程中上演。药企就是排队待审的拟上市公司,临床实验服务机构就像保荐人,而且1致性评价还有时间大限,所以仿造药企业将进入到1场剧烈的淘汰赛。”对仿造药1致性评价, 华东医药 董秘陈波如此描写。 2015年8月,国务院发布《改革药品医疗器械审评审批制度的意见》,文中明确指出“加快仿造药质量1致性评价”,力争2018年底前完成国家基本药物口服制剂与参比制剂质量1致性评价。随后两月,国家食品药品监督总局又发布《参比制剂选择和肯定》、《人体生物等效性研究技术》、《溶出曲线测定与比较》等文件。而在期初,上述出台的仿造药1致性评价政策,恐怕没有多少药企引发重视。 时间回到4年前,2012年1月,国务院在《国家药品安全“1025”计划》曾提出,全面提高仿造药质量,分期分批展开仿造药1致性评价。但由于各种缘由,推动进度缓慢,到2014年底,1致性评价工作基本堕入停滞状态。如此种种,对此轮仿造药1致性评价的实行,很多药企和业界人士在期初都不太在乎。 不过,高层对仿造药1致性的重视程度,却在药业的观望和等待中不断加大。2016年3月,国务院又发布《关于展开仿造药1致性评价的意见》。这标志着我国仿造药1致性评价,已上升至国家战略。国家食药监总局官网,乃至开辟了“仿造药1致性评价”专栏,其中今年3月以来出台的相干文件多达16份。据此,不难看出监管层对仿造药1致性评价工作的重视度。 为什么要力推仿造药1致性评价?国家食药监总局的公然表态是,仿造药质量提高了,临床上实现与原研药品相互替换,改变现在原研药在有的大医院药品销售中占比到达80%的局面,有益于下降药品总费用支出,有益于淘汰落后产能,提高国产仿造药的竞争力。 “今年以来,感觉几近每一个星期都有新文件出台。从政策出台的高规格、密集度,可以看出监管层推动1致性评价工作的速度和决心。”面对相继而至的政策,1家上市药企负责人向记者感慨。 密集出台的政策使得许多药企从此前观望状态,进入积极行动阶段。以 京新药业 为例,该公司已成立仿造药1致性评价研究中心和专职的QA部门,由公司副总经理亲身挂帅,对重点品种优先评价。公司将全部工作分解为参比制剂备案和采购、药学研究、稳定性实验、BE备案及研究、申报资料整理与上报等阶段,预估时间为16—24个月。依照这个时间进度科学决策,制定了重点品种详细的开发计划,建立研发、生产、市场部联动机制,重点推动,从而确保在2018年大限前完成。 初赛批量药企自动弃战 7月中旬,国家药监总局在杭州举行了第1期仿造药质量和疗效1致性评价培训班。根据国家药监总局的计划,江苏、山东、广东、4川、河北和黑龙江等7个制药大省,也将在8月上旬举行完成仿造药质量和疗效1致性评价培训。 多个制药大省的系列培训工作,被业界视为仿造药1致性评价工作行将全面铺开的信号。但是,从政策力推走向落地实行,到底有多少药企能顺利闯关,恐怕没有多少企业有底。 据悉,我国虽然是1个仿造药大国,但却不是仿造药强国,低水平仿造扎堆现象严重,很多药品的批文数量达几10个、乃至过百,药企之间恶性竞争。同时,大量获批上市的仿造药,从没进行过与原研药的1致性评价,普遍存在质量差、疗效弱的问题。这些因素,都为此次仿造药1致性评价增加了不肯定性。 可以左证的是,2008年,国家食药监总局曾组织过1次摸底抽查,选择部份国产仿造药与原研药进行体外溶出实验比较,发现国产仿造药与原研药体外溶出行动差异差异,无1能到达合格标准。 “药品结构决定了其化合物疗效,好比拿一样的配方做菜,我们做的菜与大厨师做的比较,口味还是会有不同。目前,很多原研药与国产仿造药比较,价格常常贵几倍,乃至几10倍,但即使这样,在急危重症、疑问病症相对集中的医治领域,患者也偏向于用进口药。这些都说明,国产仿造药的工艺仍存在差距。”对国产仿造药与原研药的差别,1家上市药企董秘这样概述。 国产仿造药与原研药的差距,也许预示着仿造药1致性评价不乐观。据了解,此次仿造药1致性评价原则主要包括:首先,与原研药品具有1样的安全性和有效性;其次,药学相等;另外,生物毒性等效。 1位地方疾控中心负责人认为,最开始,1致性评价是从临床评价开始的,即:质量、疗效相同的情况下,药企自查自纠,如有申报材料造假,未来3年不允许任何新药申报,这对药企的影响较大。当时, 恒瑞医药 、 双鹭药业 、 天士力 等国家知名药企,纷纭撤回了自己的重磅品种。 上述的药企自查自纠,是指2015年7月国家药监局展开的《药物临床实验数据自查核对工作》。自此,我国医药行业掀起了1次范围空前的在研药品撤回浪潮,触及到上市药企约30家。以恒瑞医药为例,该公司撤回的品种多达13个。 根据 海通证券 研究报告,截至3月1日,1622个文号中的1171个药品注册申请已撤回,占自查总数的72.2%。另外,24个药品注册申请CFDA不予批准,再加上4月29日公布的6个不予批准申请,30个药品合计占自查总数的1.85%。 国家食药监总局启动的新药临床实验数据自查核对工作,被部份业界人士视为仿造药1致性评价的初赛。上述疾控中心负责人称,知名药企纷纭撤回,这说明在临床进程中,还存在很多不规范的现象,来源于1期、2期数据整理不够规范,或确切做不出很好的实验效果,是不得已而为之情况下的撤回。 “33原则” 考验药企决定智慧 4年前,国家食药监总局开始推动仿造药质量1致性评价工作,分两批选择了75个试点品种进行1致性评价。但是,终究通过评价的品种寥寥可数。对1致性评价该采取的方法存在较大争议,使得这项工作到2014年处于实际停滞状态。 试点工作的前车之签,使得业界对仿药企业普遍不乐观。而且,从国家药监总局的政策要求来看,此次仿造药1致性评价是1次规定时限的高难度项目。 首先是时间紧,要求2007年10月1日前批准的国家基本药物口服制剂需在2018年底之前完成。其次是任务重,仅前述有明确政策时限的就有近300个品种,触及到1883家企业,批文数约1.8万个。 而且,此次仿造药1致性评价还指出,首家品种完成1致性评价后,其他药品生产的相同品种,原则上应在3年完成1致性评价,同品种药品通过1致性评价生产企业到达3家以上的,在药品政府采购方面不再选用未通过1致性评价的品种。上述规则,行业内俗称“33原则”。 “依照目前的政策和中介服务能力,最少3分之2的上市仿造药品种会被淘汰出局,这个毫无疑问。”上述1家上市药企负责人称。同时, 国泰君安 研究报告指出,国内制药企业基础研究较为薄弱,在参比制剂和药学评价上普遍需要从零开始,再斟酌到临床资源不足,产能瓶颈明显,预计全部1致性评价工作需要5⑴0年的时间才能完成。 相干机构统计显示,入选首批1致性评价品种批文最多的上市药企包括 上海医药 、 华润双鹤 和 白云山 ,批准文号数量分别为505个、211个和200个,药品品种分别为164个、99个和99个。 此轮仿造药的1致性评价,药企所需费用,主要触及参比制剂和临床实验两部份。前者用于购买原研药品或国际公认的同种药物;后者就是向中介服务机构购买服务。由于仿造药1致性评价预期升温,相干方面“坐地起价”,其中触及后者的费用,已从原来的50⑹0万,飙升至目前的500⑹00万元。 对很多药企而言,数百万的1致性评价费用,是1笔不小的支出。华东医药董秘陈波给记者算了1笔账,很多药品的销售1年的收入也就几百万,用10年的利润去赌1个充满未知的1致性评估,应当不是1个明智的选择。 1致性评价的实行,正在促使仿造药大户做出取舍。上海医药副总裁刘彦君表示,公司仿造药品种超过150个,这1轮评价中,恐放弃1半。“大部份药厂肯定捡赚钱少、利润薄的先扔,可能会涵盖1些‘便宜救命药’,例如出厂价只有8元钱的医治新生儿癫痫的ACTH(注射用促肾上腺皮质激素)。” 对我国很多药企来讲,能做出首仿药、2仿药已经是幸事。更多药企是在原研药的基础上做反复的模仿。比方常见的阿司匹林、维生素等大众化基药,仿造药比比皆是。根据相干机构统计,在此次仿造药1致性评价中,诺氟沙星胶囊触及的批准文号为849个,触及企业数量为750家。 “依照政策要求的3+3原则,同1基药仿造药太多,关联企业在评估经济利益这笔账的同时,还需要看同行的脸色。所以,药企现在的行动都是自己在准备,大家都在等药监局的申报预表露。听说这项工作有望下月正式启动,届时,根据申报的预表露名单,药企的工作将会更有针对性”。1家上市药企负责人称。 大浪淘沙 谁是仿造药行业赢家 1致性评价对很多仿造药企而言是1场输不起的卡位战。利益的驱使,使得彼此的天平正在产生改变。 在采访中,多位业界人士向记者提及现有政策可能会做出修正,包括“同品种药品通过1致性评价生产企业到达3家以上的,在药品政府采购方面不再选用未通过1致性评价的品种”;和“药物临床实验机构资历的认定”。 “同品种药品通过1致性评价的生产企业数量限定,可能会从3家修改成3批。另外,临床实验基地,可能会从目前原来限定范围内的3甲医院有条件的向2甲医院放开”。1位上市药企负责人对记者称。 政策修改常常是利益博弈的结果。预期中的政策修改是不是会落地不得而知,但是对普通投资者而言,可以从各方的诉求中发掘受益者。 1致性评价的经常使用方法是体外溶出和体内生物利用度实验(BE),此次1致性评价触及到品种数量巨大,这使临床实验基地成了产业链的稀缺资源。据 兴业证券 研究报告,目前,有资质从事BE研究的临床实验机构,数量仅为100多家。若按现有的BE实验基地,每家1年接5个项目来计算,1年也就可以做500个项目,远低于潜伏的BE项目的数量。 目前,药企的BE实验,常常会拜托给1家医药研发合同外包服务机构(CRO),服务费由CRO公司与临床实验基地按比例分成。临床实验基地的稀缺,使得BE实验的本钱不断爬升。记者从仿造药企及CRO公司方面得悉,“原来,做1个BE实验的费用大概50⑹0万元,现在价格已涨至500⑹00万元。而且价格照旧看涨。” 在国内资本市场,具有CRO公司的上市企业约5家,其中 泰格医药 是行业代表。BE实验费用跳涨,上述公司自然是受益者。但是在记者采访进程中,1家受访CRO企业却仍然满是“怨言”。 上述CRO公司负责人称,“目前,做1个BE实验大概需要3⑷个月,而具有临床实验资质的医院,1张病床的收入约500元/天。比较而言,医院方面觉得不划算。与此同时,国家药监总局去年的严格核对临床实验数据事件,使得医院方面的风险增大。因此,有临床实验资质的医院,承接BE实验研究的积极性降落。” 记者得悉,由于临床实验机构在链条中属于稀缺资源,其在此次1致性评价中处于相对强势地位,议价权利更高。CRO公司展开BE实验实际取得的收益,大部份会进入到临床实验机构。加上可以预感BE实验的洪峰,部份CRO公司联合仿造药企等方面,频频向监管部门上书请愿,希望监管部门后续对临床实验基地采取放开的政策。 实际上,影响仿造药1致性评价的企业,除CRO公司,还包括地位日渐提升的辅料企业。随着1致性评价推动,以 山河药辅 为代表的辅料企业,在药企心中的地位在提升。态度的转变,取决于辅料能影响到药物的溶解和吸收,进而影响到仿造药的1致性评估。 固然,在仿造药行业的淘汰赛中,触及药品较少,或具有“绿色牌照”的药企,也是这场“浩劫”的受益者。前者代表包括华东医药,该公司触及药品约5⑹个品种;后者代表包括 华海药业 。以华海药业为例,该公司是我国医药重镇——浙江台州的1家制剂企业,2004年启动国际化战略,在美国申报ANDA文号。依照2015年数据,该公司约7成收入来自海外,其中主要是美国市场。目前,该公司已具有21个ANDA文号,去年新获批的有6个,其中不乏缬沙坦等重磅品种。 具有21个ANDA文号对华海药业意味着甚么?依照目前仿造药1致性评价政策,在中国境内用同1条生产线生产上市并在欧盟、美国和日本获准上市的药品,经国家药监总局资料审核,及生产现场进行检查后,视同通过1致性评价。换而言之,手握21张金字招牌的华海药业,可以采取“出口转内销”的发展战略抢占市场。 华海药业董秘祝永华称,目前,我国的药品市场存在很多问题,对市场和渠道较为重视,但药品质量良莠不齐。而对药企和客户而言,药品的质量和安全才是生命线。1致性评价政策的实行,必将会掀起仿造药企业的洗牌和整合;同时,华东医药陈波称,1致性评价政策对相干药企的新药报批,药品研发及战略计划,都会有比较深远的影响。
医药网7月29日讯 去年8月,仿造药质量和疗效1致性评价(简称“仿造药1致性评价”)在时隔4年后,再度进入公众视野,但期初各界对此不以为然。不过,随后各种政策“补钉”及系列配套政策在今年的陆续落地,外界态度开始改变。 已上升至国家战略的仿造药1致性评价,具有时间紧、任务重、难度大、触及面广等特点。热中“饮酒吃药”的A股投资人,如果对仿造药1致性评价政策还重视不足,结局可能会很悲剧。史无前例的力推政策,使得仿造药企业如坐针毡。 这究竟是怎样1个概念?依照国家食品药品监督总局公布的时间表,政策划定的289个仿造药品种,需在2018年底前完成1致性评价,触及到1800多家药企,几近涵盖了A股所有仿造药企业。业界预计,未来3年内,制药行业进入“收入承压+本钱上升”的阵痛期。 围绕着仿造药1致性评价的相干事项,近期,证券时报记者通过对部份药企了解及实地探访,直面感受各方最新动态。也试图透过他们的所思所想,寻觅这场没有硝烟的战争中的受益者。 密集政策改变药企预期 7月的浙江骄阳似火,再加上“G20”的逼近,浙江很多企业已开启“议假模式”。但这些,对这里的仿造药企业而言是可望而不可求的。陆续出台的仿造药1致性评价政策,使得仿造药企业如坐针毡。 “A股市场的IPO大塞车,将会在仿造药1致性评价进程中上演。药企就是排队待审的拟上市公司,临床实验服务机构就像保荐人,而且1致性评价还有时间大限,所以仿造药企业将进入到1场剧烈的淘汰赛。”对仿造药1致性评价, 华东医药 董秘陈波如此描写。 2015年8月,国务院发布《改革药品医疗器械审评审批制度的意见》,文中明确指出“加快仿造药质量1致性评价”,力争2018年底前完成国家基本药物口服制剂与参比制剂质量1致性评价。随后两月,国家食品药品监督总局又发布《参比制剂选择和肯定》、《人体生物等效性研究技术》、《溶出曲线测定与比较》等文件。而在期初,上述出台的仿造药1致性评价政策,恐怕没有多少药企引发重视。 时间回到4年前,2012年1月,国务院在《国家药品安全“1025”计划》曾提出,全面提高仿造药质量,分期分批展开仿造药1致性评价。但由于各种缘由,推动进度缓慢,到2014年底,1致性评价工作基本堕入停滞状态。如此种种,对此轮仿造药1致性评价的实行,很多药企和业界人士在期初都不太在乎。 不过,高层对仿造药1致性的重视程度,却在药业的观望和等待中不断加大。2016年3月,国务院又发布《关于展开仿造药1致性评价的意见》。这标志着我国仿造药1致性评价,已上升至国家战略。国家食药监总局官网,乃至开辟了“仿造药1致性评价”专栏,其中今年3月以来出台的相干文件多达16份。据此,不难看出监管层对仿造药1致性评价工作的重视度。 为什么要力推仿造药1致性评价?国家食药监总局的公然表态是,仿造药质量提高了,临床上实现与原研药品相互替换,改变现在原研药在有的大医院药品销售中占比到达80%的局面,有益于下降药品总费用支出,有益于淘汰落后产能,提高国产仿造药的竞争力。 “今年以来,感觉几近每一个星期都有新文件出台。从政策出台的高规格、密集度,可以看出监管层推动1致性评价工作的速度和决心。”面对相继而至的政策,1家上市药企负责人向记者感慨。 密集出台的政策使得许多药企从此前观望状态,进入积极行动阶段。以 京新药业 为例,该公司已成立仿造药1致性评价研究中心和专职的QA部门,由公司副总经理亲身挂帅,对重点品种优先评价。公司将全部工作分解为参比制剂备案和采购、药学研究、稳定性实验、BE备案及研究、申报资料整理与上报等阶段,预估时间为16—24个月。依照这个时间进度科学决策,制定了重点品种详细的开发计划,建立研发、生产、市场部联动机制,重点推动,从而确保在2018年大限前完成。 初赛批量药企自动弃战 7月中旬,国家药监总局在杭州举行了第1期仿造药质量和疗效1致性评价培训班。根据国家药监总局的计划,江苏、山东、广东、4川、河北和黑龙江等7个制药大省,也将在8月上旬举行完成仿造药质量和疗效1致性评价培训。 多个制药大省的系列培训工作,被业界视为仿造药1致性评价工作行将全面铺开的信号。但是,从政策力推走向落地实行,到底有多少药企能顺利闯关,恐怕没有多少企业有底。 据悉,我国虽然是1个仿造药大国,但却不是仿造药强国,低水平仿造扎堆现象严重,很多药品的批文数量达几10个、乃至过百,药企之间恶性竞争。同时,大量获批上市的仿造药,从没进行过与原研药的1致性评价,普遍存在质量差、疗效弱的问题。这些因素,都为此次仿造药1致性评价增加了不肯定性。 可以左证的是,2008年,国家食药监总局曾组织过1次摸底抽查,选择部份国产仿造药与原研药进行体外溶出实验比较,发现国产仿造药与原研药体外溶出行动差异差异,无1能到达合格标准。 “药品结构决定了其化合物疗效,好比拿一样的配方做菜,我们做的菜与大厨师做的比较,口味还是会有不同。目前,很多原研药与国产仿造药比较,价格常常贵几倍,乃至几10倍,但即使这样,在急危重症、疑问病症相对集中的医治领域,患者也偏向于用进口药。这些都说明,国产仿造药的工艺仍存在差距。”对国产仿造药与原研药的差别,1家上市药企董秘这样概述。 国产仿造药与原研药的差距,也许预示着仿造药1致性评价不乐观。据了解,此次仿造药1致性评价原则主要包括:首先,与原研药品具有1样的安全性和有效性;其次,药学相等;另外,生物毒性等效。 1位地方疾控中心负责人认为,最开始,1致性评价是从临床评价开始的,即:质量、疗效相同的情况下,药企自查自纠,如有申报材料造假,未来3年不允许任何新药申报,这对药企的影响较大。当时, 恒瑞医药 、 双鹭药业 、 天士力 等国家知名药企,纷纭撤回了自己的重磅品种。 上述的药企自查自纠,是指2015年7月国家药监局展开的《药物临床实验数据自查核对工作》。自此,我国医药行业掀起了1次范围空前的在研药品撤回浪潮,触及到上市药企约30家。以恒瑞医药为例,该公司撤回的品种多达13个。 根据 海通证券 研究报告,截至3月1日,1622个文号中的1171个药品注册申请已撤回,占自查总数的72.2%。另外,24个药品注册申请CFDA不予批准,再加上4月29日公布的6个不予批准申请,30个药品合计占自查总数的1.85%。 国家食药监总局启动的新药临床实验数据自查核对工作,被部份业界人士视为仿造药1致性评价的初赛。上述疾控中心负责人称,知名药企纷纭撤回,这说明在临床进程中,还存在很多不规范的现象,来源于1期、2期数据整理不够规范,或确切做不出很好的实验效果,是不得已而为之情况下的撤回。 “33原则” 考验药企决定智慧 4年前,国家食药监总局开始推动仿造药质量1致性评价工作,分两批选择了75个试点品种进行1致性评价。但是,终究通过评价的品种寥寥可数。对1致性评价该采取的方法存在较大争议,使得这项工作到2014年处于实际停滞状态。 试点工作的前车之签,使得业界对仿药企业普遍不乐观。而且,从国家药监总局的政策要求来看,此次仿造药1致性评价是1次规定时限的高难度项目。 首先是时间紧,要求2007年10月1日前批准的国家基本药物口服制剂需在2018年底之前完成。其次是任务重,仅前述有明确政策时限的就有近300个品种,触及到1883家企业,批文数约1.8万个。 而且,此次仿造药1致性评价还指出,首家品种完成1致性评价后,其他药品生产的相同品种,原则上应在3年完成1致性评价,同品种药品通过1致性评价生产企业到达3家以上的,在药品政府采购方面不再选用未通过1致性评价的品种。上述规则,行业内俗称“33原则”。 “依照目前的政策和中介服务能力,最少3分之2的上市仿造药品种会被淘汰出局,这个毫无疑问。”上述1家上市药企负责人称。同时, 国泰君安 研究报告指出,国内制药企业基础研究较为薄弱,在参比制剂和药学评价上普遍需要从零开始,再斟酌到临床资源不足,产能瓶颈明显,预计全部1致性评价工作需要5⑴0年的时间才能完成。 相干机构统计显示,入选首批1致性评价品种批文最多的上市药企包括 上海医药 、 华润双鹤 和 白云山 ,批准文号数量分别为505个、211个和200个,药品品种分别为164个、99个和99个。 此轮仿造药的1致性评价,药企所需费用,主要触及参比制剂和临床实验两部份。前者用于购买原研药品或国际公认的同种药物;后者就是向中介服务机构购买服务。由于仿造药1致性评价预期升温,相干方面“坐地起价”,其中触及后者的费用,已从原来的50⑹0万,飙升至目前的500⑹00万元。 对很多药企而言,数百万的1致性评价费用,是1笔不小的支出。华东医药董秘陈波给记者算了1笔账,很多药品的销售1年的收入也就几百万,用10年的利润去赌1个充满未知的1致性评估,应当不是1个明智的选择。 1致性评价的实行,正在促使仿造药大户做出取舍。上海医药副总裁刘彦君表示,公司仿造药品种超过150个,这1轮评价中,恐放弃1半。“大部份药厂肯定捡赚钱少、利润薄的先扔,可能会涵盖1些‘便宜救命药’,例如出厂价只有8元钱的医治新生儿癫痫的ACTH(注射用促肾上腺皮质激素)。” 对我国很多药企来讲,能做出首仿药、2仿药已经是幸事。更多药企是在原研药的基础上做反复的模仿。比方常见的阿司匹林、维生素等大众化基药,仿造药比比皆是。根据相干机构统计,在此次仿造药1致性评价中,诺氟沙星胶囊触及的批准文号为849个,触及企业数量为750家。 “依照政策要求的3+3原则,同1基药仿造药太多,关联企业在评估经济利益这笔账的同时,还需要看同行的脸色。所以,药企现在的行动都是自己在准备,大家都在等药监局的申报预表露。听说这项工作有望下月正式启动,届时,根据申报的预表露名单,药企的工作将会更有针对性”。1家上市药企负责人称。 大浪淘沙 谁是仿造药行业赢家 1致性评价对很多仿造药企而言是1场输不起的卡位战。利益的驱使,使得彼此的天平正在产生改变。 在采访中,多位业界人士向记者提及现有政策可能会做出修正,包括“同品种药品通过1致性评价生产企业到达3家以上的,在药品政府采购方面不再选用未通过1致性评价的品种”;和“药物临床实验机构资历的认定”。 “同品种药品通过1致性评价的生产企业数量限定,可能会从3家修改成3批。另外,临床实验基地,可能会从目前原来限定范围内的3甲医院有条件的向2甲医院放开”。1位上市药企负责人对记者称。 政策修改常常是利益博弈的结果。预期中的政策修改是不是会落地不得而知,但是对普通投资者而言,可以从各方的诉求中发掘受益者。 1致性评价的经常使用方法是体外溶出和体内生物利用度实验(BE),此次1致性评价触及到品种数量巨大,这使临床实验基地成了产业链的稀缺资源。据 兴业证券 研究报告,目前,有资质从事BE研究的临床实验机构,数量仅为100多家。若按现有的BE实验基地,每家1年接5个项目来计算,1年也就可以做500个项目,远低于潜伏的BE项目的数量。 目前,药企的BE实验,常常会拜托给1家医药研发合同外包服务机构(CRO),服务费由CRO公司与临床实验基地按比例分成。临床实验基地的稀缺,使得BE实验的本钱不断爬升。记者从仿造药企及CRO公司方面得悉,“原来,做1个BE实验的费用大概50⑹0万元,现在价格已涨至500⑹00万元。而且价格照旧看涨。” 在国内资本市场,具有CRO公司的上市企业约5家,其中 泰格医药 是行业代表。BE实验费用跳涨,上述公司自然是受益者。但是在记者采访进程中,1家受访CRO企业却仍然满是“怨言”。 上述CRO公司负责人称,“目前,做1个BE实验大概需要3⑷个月,而具有临床实验资质的医院,1张病床的收入约500元/天。比较而言,医院方面觉得不划算。与此同时,国家药监总局去年的严格核对临床实验数据事件,使得医院方面的风险增大。因此,有临床实验资质的医院,承接BE实验研究的积极性降落。” 记者得悉,由于临床实验机构在链条中属于稀缺资源,其在此次1致性评价中处于相对强势地位,议价权利更高。CRO公司展开BE实验实际取得的收益,大部份会进入到临床实验机构。加上可以预感BE实验的洪峰,部份CRO公司联合仿造药企等方面,频频向监管部门上书请愿,希望监管部门后续对临床实验基地采取放开的政策。 实际上,影响仿造药1致性评价的企业,除CRO公司,还包括地位日渐提升的辅料企业。随着1致性评价推动,以 山河药辅 为代表的辅料企业,在药企心中的地位在提升。态度的转变,取决于辅料能影响到药物的溶解和吸收,进而影响到仿造药的1致性评估。 固然,在仿造药行业的淘汰赛中,触及药品较少,或具有“绿色牌照”的药企,也是这场“浩劫”的受益者。前者代表包括华东医药,该公司触及药品约5⑹个品种;后者代表包括 华海药业 。以华海药业为例,该公司是我国医药重镇——浙江台州的1家制剂企业,2004年启动国际化战略,在美国申报ANDA文号。依照2015年数据,该公司约7成收入来自海外,其中主要是美国市场。目前,该公司已具有21个ANDA文号,去年新获批的有6个,其中不乏缬沙坦等重磅品种。 具有21个ANDA文号对华海药业意味着甚么?依照目前仿造药1致性评价政策,在中国境内用同1条生产线生产上市并在欧盟、美国和日本获准上市的药品,经国家药监总局资料审核,及生产现场进行检查后,视同通过1致性评价。换而言之,手握21张金字招牌的华海药业,可以采取“出口转内销”的发展战略抢占市场。 华海药业董秘祝永华称,目前,我国的药品市场存在很多问题,对市场和渠道较为重视,但药品质量良莠不齐。而对药企和客户而言,药品的质量和安全才是生命线。1致性评价政策的实行,必将会掀起仿造药企业的洗牌和整合;同时,华东医药陈波称,1致性评价政策对相干药企的新药报批,药品研发及战略计划,都会有比较深远的影响。










