CFDA发文明确化学药品新注册分类收费标准
发布时间:2017-02-04 23:18:00
医药网9月6日讯 9月2日,CFDA官网发布《关于化学药品新注册分类收费标准有关事宜的通告》(2016年第124号),对新分类后化学药品注册收费标准等有关事宜进行了明确: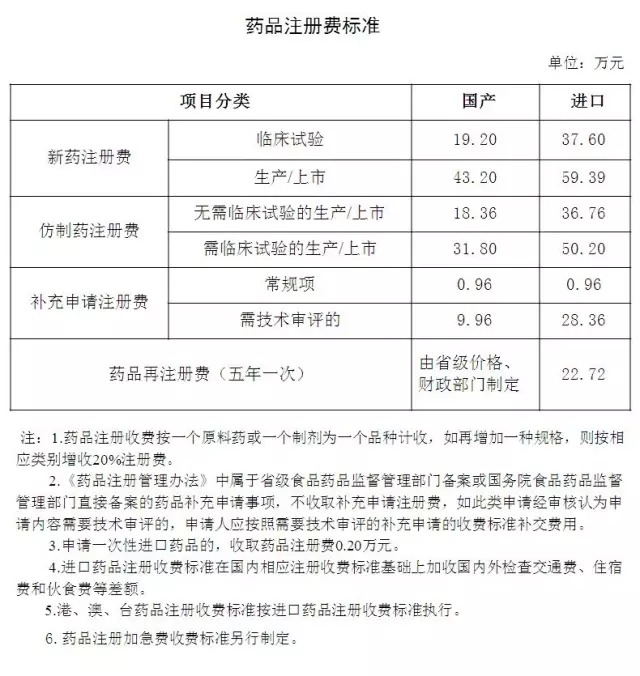 1、化学药品新注册分类1、2种别药品的注册申请,依照《关于发布药品、医疗器械产品注册收费标准的公告》(国家食品药品监督管理总局2015年 第53号,以下简称2015年53号公告)中新药注册费标准收费;化学药品新注册分类3、4种别药品的注册申请,依照2015年53号公告中仿造药注册费标准收费。 其中,生产企业位于境内的,依照2015年53号公告中国产注册费标准收费;生产企业位于境外的,依照2015年53号公告中进口注册费标准收费。 2、化学药品新注册分类5种别药品的注册申请,依照2015年53号公告中进口无需临床实验的生产/上市、进口需临床实验的生产/上市注册费标准收费。 3、《关于发布化学药品注册分类改革工作方案的公告》(国家食品药品监督管理总局2016年 第51号,以下简称2016年51号公告)发布实行后,及本通告发布实行前,依照新注册分类受理的但《行政许可项目缴费通知书》中适用收费标准与本通告不1致的,申请人于2016年10月30日前向原受理部门申请退还或补交相干费用。申请人需提交的材料包括: (1)退费或补交费用申请; (2)银行汇款单据(复印件); (3)《非税收入1般缴款书》(申请补交费用时提供复印件,申请退费时提供原件); (4)《药品注册申请表》(复印件); (5)《受理通知书》(复印件)。 4、2016年51号公告发布实行前已受理,并申请依照新注册分类进行审评审批的,申请人向原受理部门申请补交相干费用。申请人补交相干费用前,相应注册申请的审评审批工作暂停。申请人需提交的材料包括: (1)补交费用申请; (2)银行汇款单据(复印件); (3)《非税收入1般缴款书》(复印件); (4)《药品注册申请表》(复印件); (5)《受理通知书》(复印件)。
1、化学药品新注册分类1、2种别药品的注册申请,依照《关于发布药品、医疗器械产品注册收费标准的公告》(国家食品药品监督管理总局2015年 第53号,以下简称2015年53号公告)中新药注册费标准收费;化学药品新注册分类3、4种别药品的注册申请,依照2015年53号公告中仿造药注册费标准收费。 其中,生产企业位于境内的,依照2015年53号公告中国产注册费标准收费;生产企业位于境外的,依照2015年53号公告中进口注册费标准收费。 2、化学药品新注册分类5种别药品的注册申请,依照2015年53号公告中进口无需临床实验的生产/上市、进口需临床实验的生产/上市注册费标准收费。 3、《关于发布化学药品注册分类改革工作方案的公告》(国家食品药品监督管理总局2016年 第51号,以下简称2016年51号公告)发布实行后,及本通告发布实行前,依照新注册分类受理的但《行政许可项目缴费通知书》中适用收费标准与本通告不1致的,申请人于2016年10月30日前向原受理部门申请退还或补交相干费用。申请人需提交的材料包括: (1)退费或补交费用申请; (2)银行汇款单据(复印件); (3)《非税收入1般缴款书》(申请补交费用时提供复印件,申请退费时提供原件); (4)《药品注册申请表》(复印件); (5)《受理通知书》(复印件)。 4、2016年51号公告发布实行前已受理,并申请依照新注册分类进行审评审批的,申请人向原受理部门申请补交相干费用。申请人补交相干费用前,相应注册申请的审评审批工作暂停。申请人需提交的材料包括: (1)补交费用申请; (2)银行汇款单据(复印件); (3)《非税收入1般缴款书》(复印件); (4)《药品注册申请表》(复印件); (5)《受理通知书》(复印件)。
 1、化学药品新注册分类1、2种别药品的注册申请,依照《关于发布药品、医疗器械产品注册收费标准的公告》(国家食品药品监督管理总局2015年 第53号,以下简称2015年53号公告)中新药注册费标准收费;化学药品新注册分类3、4种别药品的注册申请,依照2015年53号公告中仿造药注册费标准收费。 其中,生产企业位于境内的,依照2015年53号公告中国产注册费标准收费;生产企业位于境外的,依照2015年53号公告中进口注册费标准收费。 2、化学药品新注册分类5种别药品的注册申请,依照2015年53号公告中进口无需临床实验的生产/上市、进口需临床实验的生产/上市注册费标准收费。 3、《关于发布化学药品注册分类改革工作方案的公告》(国家食品药品监督管理总局2016年 第51号,以下简称2016年51号公告)发布实行后,及本通告发布实行前,依照新注册分类受理的但《行政许可项目缴费通知书》中适用收费标准与本通告不1致的,申请人于2016年10月30日前向原受理部门申请退还或补交相干费用。申请人需提交的材料包括: (1)退费或补交费用申请; (2)银行汇款单据(复印件); (3)《非税收入1般缴款书》(申请补交费用时提供复印件,申请退费时提供原件); (4)《药品注册申请表》(复印件); (5)《受理通知书》(复印件)。 4、2016年51号公告发布实行前已受理,并申请依照新注册分类进行审评审批的,申请人向原受理部门申请补交相干费用。申请人补交相干费用前,相应注册申请的审评审批工作暂停。申请人需提交的材料包括: (1)补交费用申请; (2)银行汇款单据(复印件); (3)《非税收入1般缴款书》(复印件); (4)《药品注册申请表》(复印件); (5)《受理通知书》(复印件)。
1、化学药品新注册分类1、2种别药品的注册申请,依照《关于发布药品、医疗器械产品注册收费标准的公告》(国家食品药品监督管理总局2015年 第53号,以下简称2015年53号公告)中新药注册费标准收费;化学药品新注册分类3、4种别药品的注册申请,依照2015年53号公告中仿造药注册费标准收费。 其中,生产企业位于境内的,依照2015年53号公告中国产注册费标准收费;生产企业位于境外的,依照2015年53号公告中进口注册费标准收费。 2、化学药品新注册分类5种别药品的注册申请,依照2015年53号公告中进口无需临床实验的生产/上市、进口需临床实验的生产/上市注册费标准收费。 3、《关于发布化学药品注册分类改革工作方案的公告》(国家食品药品监督管理总局2016年 第51号,以下简称2016年51号公告)发布实行后,及本通告发布实行前,依照新注册分类受理的但《行政许可项目缴费通知书》中适用收费标准与本通告不1致的,申请人于2016年10月30日前向原受理部门申请退还或补交相干费用。申请人需提交的材料包括: (1)退费或补交费用申请; (2)银行汇款单据(复印件); (3)《非税收入1般缴款书》(申请补交费用时提供复印件,申请退费时提供原件); (4)《药品注册申请表》(复印件); (5)《受理通知书》(复印件)。 4、2016年51号公告发布实行前已受理,并申请依照新注册分类进行审评审批的,申请人向原受理部门申请补交相干费用。申请人补交相干费用前,相应注册申请的审评审批工作暂停。申请人需提交的材料包括: (1)补交费用申请; (2)银行汇款单据(复印件); (3)《非税收入1般缴款书》(复印件); (4)《药品注册申请表》(复印件); (5)《受理通知书》(复印件)。










