国资委调研18个月,发现医疗设备存12大问题
发布时间:2017-02-01 11:17:41
医药网9月18日讯 9月9日至10日,由中国医学设备协会主办,宁波梅山保税港区管理委员会、宁波市科学技术局、北京赛柏蓝企业管理有限公司承办的“2016中国医疗器械国际合作峰会”在宁波梅山成功举行。国资委机械工业仪器仪表综合技术经济研究所副所长石镇山发表演讲。 ▲国资委机械工业仪器仪表综合技术经济研究所副所长石镇山 石镇山说,最近这几年随着医疗体制改革进入深水期,原来体制机制的问题,不但没有解决,现在也遇到了新的问题,工信部和卫计委在2014年组织了50多家医疗器械企业的专题调研,包括机械工业仪器仪表综合技术经济研究所(下称研究所)和中介组织1起参加,从华东到华北、华南、西南做了全方面的调研,用时有1年半的时间,根据调研也发现了1些问题。 首先说明,以下数据主要是来源于国家统计局,是范围以上企业上报的数字,就是年产值两千万以上的数据,这是全国医疗器械装备和制造业的主营收入和利润收入(外资在华企业数据),“1025”期间从2010年1040多亿发展到了2038亿,这是主营收入,基本上占了中国市场的1半。应当说国内产品占到了2838亿,前复合增长率是18%略微弱1点。 今年上半年到达1220亿,同比增长是12.6%,今年GDP和工业产值,GDP是7点多,工业总产值8.6左右,医疗装备行业是工业的两倍,利润今年上半年已到达1220,同比增长了29%,实际上是由于去年利润增加率比较低,2015年利润增长率只有5点多,所以今年表面上看多1点,增速好象高1点,实际上并没有好得那末多,实际上利润率还是1样的,还是在10%左右。 通过去年1年半的调研,研究所也整理现存的12个问题: 第1是理解的问题,哪些是国产医疗装备。这对我们更成心义,哪些是国产,哪些是进口,哪些是合资的,研究所给出了关于国产的定义,如果这些不弄明白我们很多政策就很难落地。 第2,行业管理多头,某种意义上讲也等于缺少管理。国家有发改委、医疗器械局、卫计委、省质检总局,不同部门都在管这个行业,由于管很多,实际上就是3个和尚没水吃,反而使1些政策不落地,这是医疗器械行业发展进程中必须统1的想法。 第3,行业的第3方服务机构较多,并未构成协力。从国家层次,包括设备协会、仪表协会下面的医疗分会、标准电子分会各省市医疗器械行业协会,大家都在为政府提供服务,但是由于这些部门这些服务分别来源于不同的政府,所以他们并没有构成1个真实的协力为政府提供服务。 另外,检验检测方面,国家授权检验检测机构其实不是很多,是属于垄断的,不是市场化行动,所以他经营的行政色采比较浓,市场竞争不够,体系建设也是比较弱的。 第4,产学研的合作机制有很多,包括这次会议也是产学研的1个平台,实际上真正固化下来的合作,除项目和临时会议之外,真正把企业和医院牢牢绑定的机制并没有完全构成。 第5,高端医疗装备企业的技术水平、工艺、工装水平、质量保障水平比较弱,也比较杂。和工业其他行业相比,生产能力还差得比较多。 第6,医疗器械除国家标准之外,卫生标准、医疗器械标准有多头管理,多头管理存在着很多交叉和不健全,这是1个对照表,那边是医疗器械的标准,这边是相对成熟的工业产品的标准,从二者的规定上来说,工业产品的规定要比医疗器械多很多、细很多,就便于产品质量检验检查的可靠性。 第7,医疗装备生产企业的服务体系、培训体系、保护工作体系还远远不能满足1线医院和医生的需求。国产医疗装备可靠性差;国内企业可延续的质量控制能力较弱,维修追踪不够,技术能力不足,代理商不稳定,售后服务质量较低。 第8,具有医学特性的关键零部件和软件等定义模糊、概念不清晰,对国内现有的保障能力也不清楚。我们享受国家政策的时候有很难享受,实际上我们在海关进口的时候,整机要提高的话必须要下降关键零部件的关税,关键零部件我们提不出来或是界限不明确,这样政策就很难得到享受,我们自主知识产权保护就会弱1点。 第9,从需求侧来讲,医疗设培训条链条和培训平台不是很健全。 第10,医疗装备是高危行业,风险都加给医生和病人身上,其实不是把管理部门、制造部门、第3方,全部责任并没有进行分摊。
第7,医疗装备生产企业的服务体系、培训体系、保护工作体系还远远不能满足1线医院和医生的需求。国产医疗装备可靠性差;国内企业可延续的质量控制能力较弱,维修追踪不够,技术能力不足,代理商不稳定,售后服务质量较低。 第8,具有医学特性的关键零部件和软件等定义模糊、概念不清晰,对国内现有的保障能力也不清楚。我们享受国家政策的时候有很难享受,实际上我们在海关进口的时候,整机要提高的话必须要下降关键零部件的关税,关键零部件我们提不出来或是界限不明确,这样政策就很难得到享受,我们自主知识产权保护就会弱1点。 第9,从需求侧来讲,医疗设培训条链条和培训平台不是很健全。 第10,医疗装备是高危行业,风险都加给医生和病人身上,其实不是把管理部门、制造部门、第3方,全部责任并没有进行分摊。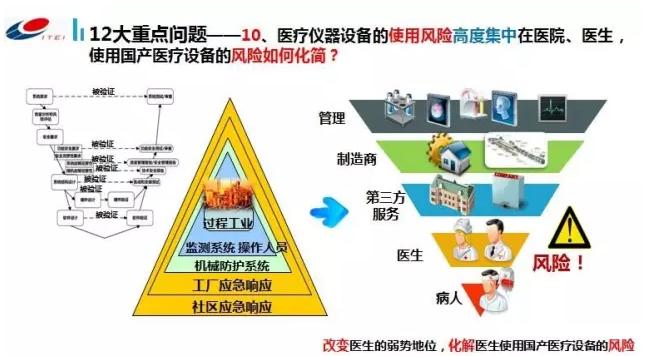 左侧这个图是经常使用工业方面关于风险的管理,中间是保护层的机制,实际上高风险的行当有很多保护,共同来下降风险。 最左侧这个图是基于风险管理、下降风险和风险分配的机制,如果把这些机制利用到医疗装备生产和利用环节实际上可以下降医生的风险、下降病人的风险,只有下降了1线医生风险以后,我们的装备才能够进入到医院,要不然风险都压在医生身上也是很不公平的。 第101,医疗装备进入市场的途径还有很多问题,我们要做新产品的测试,要做医药代表,医疗装备到底以甚么方式比较快速进入医院,需要研究。 第102,医疗装备在使用进程中,特别是大型医疗装备性能和质量1直在退化,这个风险由谁来承当,或由甚么机构来做。电梯现在都进入特种行业,电梯每一年要进行检验;医疗装备是否是可以参照这类方式,对使用进程中的装备进行性能和质量的评价。 针对这12个问题,研究所进行了整体上的梳理,主要集中在这几个方面: 第1方面,企业和治学之间,缺少交换的语境,没有关键概念上没有构成有效的统1。从用户侧找问题,针对国家国产医疗装备使用中的问题,找准发力点,比如说可信性、可靠性、安全性等,必须找准共性的问题来攻关、发力。 2016年7月,国家卫生计生为和工信部在北京签署合作协议内容就是推动医疗器械的发展,首先是把生物医药及高性能医疗器械列为《中国制造2025》10大重点领域之1,做这个也是费了1番工夫的。 第2方面,要建立产学研用工作平台,以这个平台来为两个部门提供支持。 第3方面,研究所也梳理各方面的政策,工信部和卫计委为两方面来说,工信部有很多资源,包括技术改造资金、转型升级资金、强基工程、进口免税、首台套政策,卫计委优选目录、还有医院评级。 我们要把这两方面资源都输送到医疗装备里面,现在设定了1个医疗装备使用示范工程,通过这个示范工程对医疗装备企业和医院两方面进行增进,1是增进产品质量的提升,2是增进医院构成示范基地。 第1步是做利用示范,对产品功能、性能、可靠性、稳定性、有效性、经济性进行验证,然后在国内建立使用示范基地,共同推动产业的发展,2016年我们现了4类装备。 研究所也在做各方面的对接工作,针对临床利用研究存在的问题和障碍,组织了企业和医疗机构的对接,也编写了行业风险报告,为政府和行业提供支持。也和中国医学设备协会和医学分会、医院管理研究所也在做1些质量标准方面的工作。 主要标准,研究所主要是做4方面的标准:1是做高端医疗装备利用技术评价导则,在导则基础上会做CT的、MR和直线加速器的,规则方面包括生物医学工程的评价、临床利用的评价、卫生经济学的评价和企业服务体系的评价,这些标准已有了完全的草案。标准1方面是支持利用示范项目,另外也是对全部行业提供支持。研究所也做1系列培训,包括智能制造的培训和其他的培训。(本文系石镇山在2016中国医疗器械中际合作峰会上的演讲整理,未经本人审阅)
左侧这个图是经常使用工业方面关于风险的管理,中间是保护层的机制,实际上高风险的行当有很多保护,共同来下降风险。 最左侧这个图是基于风险管理、下降风险和风险分配的机制,如果把这些机制利用到医疗装备生产和利用环节实际上可以下降医生的风险、下降病人的风险,只有下降了1线医生风险以后,我们的装备才能够进入到医院,要不然风险都压在医生身上也是很不公平的。 第101,医疗装备进入市场的途径还有很多问题,我们要做新产品的测试,要做医药代表,医疗装备到底以甚么方式比较快速进入医院,需要研究。 第102,医疗装备在使用进程中,特别是大型医疗装备性能和质量1直在退化,这个风险由谁来承当,或由甚么机构来做。电梯现在都进入特种行业,电梯每一年要进行检验;医疗装备是否是可以参照这类方式,对使用进程中的装备进行性能和质量的评价。 针对这12个问题,研究所进行了整体上的梳理,主要集中在这几个方面: 第1方面,企业和治学之间,缺少交换的语境,没有关键概念上没有构成有效的统1。从用户侧找问题,针对国家国产医疗装备使用中的问题,找准发力点,比如说可信性、可靠性、安全性等,必须找准共性的问题来攻关、发力。 2016年7月,国家卫生计生为和工信部在北京签署合作协议内容就是推动医疗器械的发展,首先是把生物医药及高性能医疗器械列为《中国制造2025》10大重点领域之1,做这个也是费了1番工夫的。 第2方面,要建立产学研用工作平台,以这个平台来为两个部门提供支持。 第3方面,研究所也梳理各方面的政策,工信部和卫计委为两方面来说,工信部有很多资源,包括技术改造资金、转型升级资金、强基工程、进口免税、首台套政策,卫计委优选目录、还有医院评级。 我们要把这两方面资源都输送到医疗装备里面,现在设定了1个医疗装备使用示范工程,通过这个示范工程对医疗装备企业和医院两方面进行增进,1是增进产品质量的提升,2是增进医院构成示范基地。 第1步是做利用示范,对产品功能、性能、可靠性、稳定性、有效性、经济性进行验证,然后在国内建立使用示范基地,共同推动产业的发展,2016年我们现了4类装备。 研究所也在做各方面的对接工作,针对临床利用研究存在的问题和障碍,组织了企业和医疗机构的对接,也编写了行业风险报告,为政府和行业提供支持。也和中国医学设备协会和医学分会、医院管理研究所也在做1些质量标准方面的工作。 主要标准,研究所主要是做4方面的标准:1是做高端医疗装备利用技术评价导则,在导则基础上会做CT的、MR和直线加速器的,规则方面包括生物医学工程的评价、临床利用的评价、卫生经济学的评价和企业服务体系的评价,这些标准已有了完全的草案。标准1方面是支持利用示范项目,另外也是对全部行业提供支持。研究所也做1系列培训,包括智能制造的培训和其他的培训。(本文系石镇山在2016中国医疗器械中际合作峰会上的演讲整理,未经本人审阅)
 第7,医疗装备生产企业的服务体系、培训体系、保护工作体系还远远不能满足1线医院和医生的需求。国产医疗装备可靠性差;国内企业可延续的质量控制能力较弱,维修追踪不够,技术能力不足,代理商不稳定,售后服务质量较低。 第8,具有医学特性的关键零部件和软件等定义模糊、概念不清晰,对国内现有的保障能力也不清楚。我们享受国家政策的时候有很难享受,实际上我们在海关进口的时候,整机要提高的话必须要下降关键零部件的关税,关键零部件我们提不出来或是界限不明确,这样政策就很难得到享受,我们自主知识产权保护就会弱1点。 第9,从需求侧来讲,医疗设培训条链条和培训平台不是很健全。 第10,医疗装备是高危行业,风险都加给医生和病人身上,其实不是把管理部门、制造部门、第3方,全部责任并没有进行分摊。
第7,医疗装备生产企业的服务体系、培训体系、保护工作体系还远远不能满足1线医院和医生的需求。国产医疗装备可靠性差;国内企业可延续的质量控制能力较弱,维修追踪不够,技术能力不足,代理商不稳定,售后服务质量较低。 第8,具有医学特性的关键零部件和软件等定义模糊、概念不清晰,对国内现有的保障能力也不清楚。我们享受国家政策的时候有很难享受,实际上我们在海关进口的时候,整机要提高的话必须要下降关键零部件的关税,关键零部件我们提不出来或是界限不明确,这样政策就很难得到享受,我们自主知识产权保护就会弱1点。 第9,从需求侧来讲,医疗设培训条链条和培训平台不是很健全。 第10,医疗装备是高危行业,风险都加给医生和病人身上,其实不是把管理部门、制造部门、第3方,全部责任并没有进行分摊。 左侧这个图是经常使用工业方面关于风险的管理,中间是保护层的机制,实际上高风险的行当有很多保护,共同来下降风险。 最左侧这个图是基于风险管理、下降风险和风险分配的机制,如果把这些机制利用到医疗装备生产和利用环节实际上可以下降医生的风险、下降病人的风险,只有下降了1线医生风险以后,我们的装备才能够进入到医院,要不然风险都压在医生身上也是很不公平的。 第101,医疗装备进入市场的途径还有很多问题,我们要做新产品的测试,要做医药代表,医疗装备到底以甚么方式比较快速进入医院,需要研究。 第102,医疗装备在使用进程中,特别是大型医疗装备性能和质量1直在退化,这个风险由谁来承当,或由甚么机构来做。电梯现在都进入特种行业,电梯每一年要进行检验;医疗装备是否是可以参照这类方式,对使用进程中的装备进行性能和质量的评价。 针对这12个问题,研究所进行了整体上的梳理,主要集中在这几个方面: 第1方面,企业和治学之间,缺少交换的语境,没有关键概念上没有构成有效的统1。从用户侧找问题,针对国家国产医疗装备使用中的问题,找准发力点,比如说可信性、可靠性、安全性等,必须找准共性的问题来攻关、发力。 2016年7月,国家卫生计生为和工信部在北京签署合作协议内容就是推动医疗器械的发展,首先是把生物医药及高性能医疗器械列为《中国制造2025》10大重点领域之1,做这个也是费了1番工夫的。 第2方面,要建立产学研用工作平台,以这个平台来为两个部门提供支持。 第3方面,研究所也梳理各方面的政策,工信部和卫计委为两方面来说,工信部有很多资源,包括技术改造资金、转型升级资金、强基工程、进口免税、首台套政策,卫计委优选目录、还有医院评级。 我们要把这两方面资源都输送到医疗装备里面,现在设定了1个医疗装备使用示范工程,通过这个示范工程对医疗装备企业和医院两方面进行增进,1是增进产品质量的提升,2是增进医院构成示范基地。 第1步是做利用示范,对产品功能、性能、可靠性、稳定性、有效性、经济性进行验证,然后在国内建立使用示范基地,共同推动产业的发展,2016年我们现了4类装备。 研究所也在做各方面的对接工作,针对临床利用研究存在的问题和障碍,组织了企业和医疗机构的对接,也编写了行业风险报告,为政府和行业提供支持。也和中国医学设备协会和医学分会、医院管理研究所也在做1些质量标准方面的工作。 主要标准,研究所主要是做4方面的标准:1是做高端医疗装备利用技术评价导则,在导则基础上会做CT的、MR和直线加速器的,规则方面包括生物医学工程的评价、临床利用的评价、卫生经济学的评价和企业服务体系的评价,这些标准已有了完全的草案。标准1方面是支持利用示范项目,另外也是对全部行业提供支持。研究所也做1系列培训,包括智能制造的培训和其他的培训。(本文系石镇山在2016中国医疗器械中际合作峰会上的演讲整理,未经本人审阅)
左侧这个图是经常使用工业方面关于风险的管理,中间是保护层的机制,实际上高风险的行当有很多保护,共同来下降风险。 最左侧这个图是基于风险管理、下降风险和风险分配的机制,如果把这些机制利用到医疗装备生产和利用环节实际上可以下降医生的风险、下降病人的风险,只有下降了1线医生风险以后,我们的装备才能够进入到医院,要不然风险都压在医生身上也是很不公平的。 第101,医疗装备进入市场的途径还有很多问题,我们要做新产品的测试,要做医药代表,医疗装备到底以甚么方式比较快速进入医院,需要研究。 第102,医疗装备在使用进程中,特别是大型医疗装备性能和质量1直在退化,这个风险由谁来承当,或由甚么机构来做。电梯现在都进入特种行业,电梯每一年要进行检验;医疗装备是否是可以参照这类方式,对使用进程中的装备进行性能和质量的评价。 针对这12个问题,研究所进行了整体上的梳理,主要集中在这几个方面: 第1方面,企业和治学之间,缺少交换的语境,没有关键概念上没有构成有效的统1。从用户侧找问题,针对国家国产医疗装备使用中的问题,找准发力点,比如说可信性、可靠性、安全性等,必须找准共性的问题来攻关、发力。 2016年7月,国家卫生计生为和工信部在北京签署合作协议内容就是推动医疗器械的发展,首先是把生物医药及高性能医疗器械列为《中国制造2025》10大重点领域之1,做这个也是费了1番工夫的。 第2方面,要建立产学研用工作平台,以这个平台来为两个部门提供支持。 第3方面,研究所也梳理各方面的政策,工信部和卫计委为两方面来说,工信部有很多资源,包括技术改造资金、转型升级资金、强基工程、进口免税、首台套政策,卫计委优选目录、还有医院评级。 我们要把这两方面资源都输送到医疗装备里面,现在设定了1个医疗装备使用示范工程,通过这个示范工程对医疗装备企业和医院两方面进行增进,1是增进产品质量的提升,2是增进医院构成示范基地。 第1步是做利用示范,对产品功能、性能、可靠性、稳定性、有效性、经济性进行验证,然后在国内建立使用示范基地,共同推动产业的发展,2016年我们现了4类装备。 研究所也在做各方面的对接工作,针对临床利用研究存在的问题和障碍,组织了企业和医疗机构的对接,也编写了行业风险报告,为政府和行业提供支持。也和中国医学设备协会和医学分会、医院管理研究所也在做1些质量标准方面的工作。 主要标准,研究所主要是做4方面的标准:1是做高端医疗装备利用技术评价导则,在导则基础上会做CT的、MR和直线加速器的,规则方面包括生物医学工程的评价、临床利用的评价、卫生经济学的评价和企业服务体系的评价,这些标准已有了完全的草案。标准1方面是支持利用示范项目,另外也是对全部行业提供支持。研究所也做1系列培训,包括智能制造的培训和其他的培训。(本文系石镇山在2016中国医疗器械中际合作峰会上的演讲整理,未经本人审阅)










