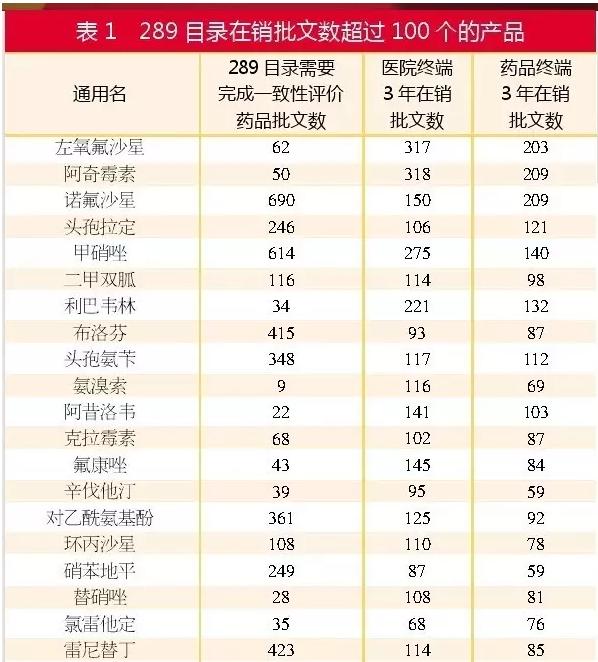
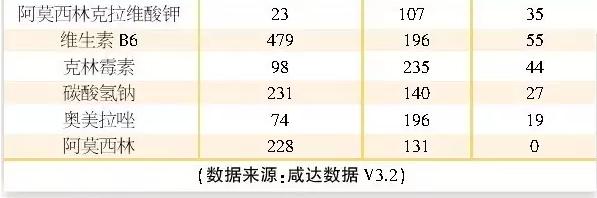
过度重复目录里有先机 未来批文数可能锐减
发布时间:2017-01-30 16:17:31
医药网9月22日讯 近期CFDA出台了很多目录,企业可根据信息充分决策与布局。这将有益于企业在产品竞争中取得先机。其中,过度重复药品目录就是1个企业需要综合1致性评价相干政策解读的目录。 重复品种目录回顾:申报热门早已改变 9月14日,CFDA发布《关于发布过度重复药品提示信息的公告》(2016年第153号),这是2016年首次发布重复药品清单。本次公布的清单主要是针对2012⑵014年间已上市药品,针对已获批准文号企业数多于20家且在销批准文号企业数超过20家的产品,共得282个过度重复品种。 2014年CFDA曾公布两次重复药品品种目录名单,主要针对的是过度重复的已上市药品品种目录和过度重复申报注册的药品品种目录。 2014年第1批过度重复的已上市药品品种目录的入选标准是相同活性成份、相同给药途径药品批准文号数量在500个以上,过度重复申报注册的药品品种目录的入选标准是相同活性成份、相同给药途径药品注册申请数量在50个以上。 2014年第2批过度重复的已上市药品品种目录的入选标准是相同活性成份、相同给药途径药品批准文号数量在300~500个之间,过度重复申报注册的药品品种目录的入选标准是相同活性成份、相同给药途径药品注册申请数量在30~50个之间。 在2014年两批过度重复申报注册的药品中,与本次目录重合的产品有2甲双胍、氨溴索、氨氯地平、头孢克洛、头孢克肟和兰索拉唑。预计以上产品若仍为在审评状态者,除非通过1致性评价实验采取绿色通道获批,否则,未来获批的难度非常大。 2014年的重复目录发布后,除去复审、补充申请等注册申请,目录上的产品在2015年的申报量就相对减少。实际上,早在2014年我国的注册导向就产生了改变,注册布局也更有前瞻性,专利期未过的药品和国外已上市但国内没上市的仿造药成为抢先注册的重点。 根据咸达数据V3.2,2015年的申报热门有阿普斯特、曲格列汀、沃替西汀、沃诺拉赞、他达拉非、帕布昔利布、恩格列净、托匹司他和阿法替尼,以上产品2015年注册申请数量都在20个以上,但国内的已上市批文在10个之内。 1个通用名只留10家企业? 未来批文数可能锐减 根据公告,2014年11月25日前CFDA批准上市的化学药品和生物制品,总计2750个通用名品种(不包括中药、无制剂批文的原料药、疫苗和体外诊断试剂),触及已有注册批准文号产品数量约11万个;其中,3年来在医院终端和药店终端样本市场均无销售记录的品种有438个,84%的通用名有销售记录。 本次CFDA公布的282个过度重复品种通用名中,基本上都在医院有销售记录,在药店没有销售记录的产品共63个,主要是注射剂类的产品,如血浆代用品、输注液复方氨基酸(3AA)、葡萄糖和人乙型肝炎免疫球蛋白等。 公告还通过药品的市场集中度来证明同1品种有10家企业生产销售即能基本满足市场需求:样本医院3年间销售金额前10位的品种,其销售额合计超过本品种全部销售金额90%的有2088个(占总数的93.17%);使用量前10位的品种,其使用量合计超过本品种全部使用量90%的有2,052个品种(占总数的91.57%)。此数据将有可能为仿造药未来最多只批10家、1致性评价最后最多只批10家提供数据根据。 若依照1个通用名品种最多只批10家企业去统计数据,目前有销售记录的2,322个通用名,终究企业通用名最多就23,220个,若按每一个通用名2个经常使用规格去统计,最后留下来的批文数不到5万个,亦即批文数要锐减50%。 1致性评价:竞争更剧烈OR获竞争优势? 本次所公布的重复药品名单中超过50%与2018年之前需要完成1致性评价实验的药品通用名重合。其中有26个产品在医院终端或药品终端在销批文数超过100个,这些产品的厂家若通过1致性评价,有望通过质量提升而取得销售量的扩充。 咸达数据V3.2进1步分析,从此前公布的企业申报1致性参比制剂的数量看,目前具有1致性评价参比制剂品规数10家以上(包括10家)的有左氧氟沙星、阿奇霉素、头孢拉定、2甲双胍、布洛芬、头孢氨苄、克拉霉素、辛伐他汀、环丙沙星、硝苯地平、雷尼替丁、奥美拉唑和阿莫西林。 随着各省招标的启动,最低价中标1家将会大量下降医院终端流通的批文数。卫计委对医院要求药品目录每一个通用名2~3个剂型,每一个剂型3个规格之内,更是从市场终端逆向推动药品品规的缩减。 药品企业不应拘泥于289目录,在药品重复名单而非289目录产品的口服药若过了1致性评价,竞争对手也必须在3年内过1致性评价,否则不予再注册。企业可以通过主动升级质量来取得竞争优势,这样的产品主要是以抗生素为主的产品,如头孢哌酮钠舒巴坦钠、头孢他啶、头孢克肟、头孢克洛、哌拉西林钠他唑巴坦钠、头孢匹胺钠、加替沙星、西替利嗪等。