一致性评价品种选择教程:全面分析药品价值,抉择前完成三步骤
发布时间:2017-01-28 19:17:18
医药网9月28日讯 在《关于展开仿造药质量和疗效1致性评价的工作意见》(国办发[2016]8号)下发以后,国务院、CFDA、中检院前后发布了20余个相干公告,公告触及1致性评价的各个环节,从发布公告的频度和密集程度可以看出此项1致性评价工作不同于以往工作的特点,相当严肃且相当紧急。并且,展开仿造药1致性评价工作业已被列入“1035”计划重点任务,上升到了国家战略层面。面对这项工作,仿造药企“家家有本难念的经”,选择哪些品种展开1致性评价是其中1个关键的难点问题。 背景与难度 1、必定性 淘汰行业低端产能,仿造药1致性评价是推动供给侧结构性改革的重大举措。目前国内原研药在大医院药品销售占比高达80%,仿造药质量良莠不齐,提高仿造药质量,临床上实现与原研药相互替换,才能够推动药品生产领域的结构性变革。据了解,国内仿造药行业毛利率不到10%(国际平均水平约为40%⑸0%),而且过半品种高度重复。 1致性评价是提升国产仿造药国际竞争力的必由之路,也是减缓国内医保、药价新政压力的必定选择。 仿造药与原研药1致性是国际通行原则,1致性评价是很多国家都走过的路。上世纪70年代,美国启动仿造药生物等效性评价,开始关注仿造药的疗效,用时10年,淘汰6000种未通过1致性评价的药品。英国曾对3.6万种药品进行1致性评价。日本则于上世纪90年代末启动药品品质再评价工程。上述3个国家都实现了仿造药产业的升级,药品质量、行业生态、工业价值得以显著提升。我国2001年修订的《药品管理法》,把仿造药集中到国家统1审批,开始要求仿造药作临床实验;2007年鼓励仿造原研药,但还不是强迫性要求。《国家药品安全“1025”计划》印发时,提出了仿造药与原研药质量1致性评价的任务;去年国务院的44号文,提出质量疗效与原研药1致的要求。1致性评价,在国内可以说是“补课”。 2、选择难度 笔者梳理发现,目前首批需要在2018年底完成1致性评价的基本药物口服制剂品种289个,通用名198个,触及批准文号17740个,国内生产企业1817家,进口企业42家(见表1)。批准文号的品种重复性极高,1个品种超过300个品准文号的有16种,100个批准文号的有44种。仅复方磺胺甲噁唑片,共有895个文号、869家企业生产。如果企业对所有的批准文号都进行1致性评价,明显不现实,评价时间也有限,每品种的评价费用约为500万⑹00万元。基药2015年全部销售收入按全部药品销售收入的40%来计的话,1致性评价所花的费用大约会超过基药全年全部销售收入的20%。那末,企业面临的问题也就出来了:到底要不要做?做哪些?先做哪些?如何选择? 经济学是专门研究选择的学科,经济学对资源配置选择根据是商品的价值,需要分析药品的价值到底包括哪些、如何根据药品的价值做出公道的选择。 表1:首批需要在2018年底完成1致性评价的基药口服制剂品种基本情况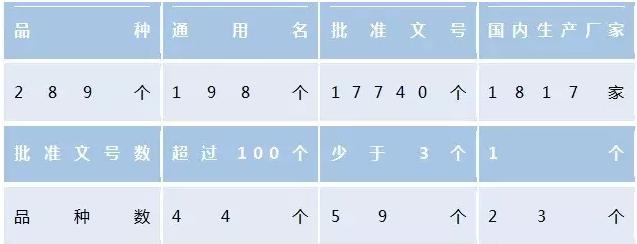 药品的价值内涵与构成 首先看商品价值。宏观意义上讲,商品价值包括两部份:1部份是商品内在的使用价值,反应商品的本质属性——用处是甚么;另外一部份是商品的市场价值,反应其社会属性,人们愿意为取得使用价值而付出的代价。商品的使用价值需要通过市场价值来体现,同时市场价值更多反应的是消费的意愿和需求。 药品价值一样包括使用价值和市场价值,使用价值就是药品本身的功能,用于医治、诊断、预防人的疾病,也就是药品的使用价值来自于临床;市场价值则是这类临床价值的消费意愿和需求,也就是人们对健康改良或健康水平提高愿意付出的代价。药品关乎人的健康与生命安全,因此其还具有更多的公益性和社会福利属性,药品行业的发展直接关乎政府的公信力,由此,药品还具有另外1个特殊的价值,就是社会价值。 1、临床价值 这是药品最核心的价值,是决定市场价值和社会价值的基础。国际上,很多国家(如德、法等)非常关注药物的临床价值,将其作为药品相干决策的重要根据,如药品的定价、医保目录的遴选、临床用药指南的制定等。 德国从2011 年实行的《医药行业改革法案》( AMONG),将创新药品的附加效益划分为重大、显著、较小、附加效益不可量化、不具有附加效益和效益低于对比疗法6个等级,前3个等级药品具有附加效益,后3个等级不具有附加效益,同时规定如果药品附加效益不被接受,则将该药划入参考价格组来肯定医保支付价格,如果具有附加效益则药企可以和基金委员会协商肯定医保支付价格,常常要比参考价格组肯定的价格高出很多。附加效益的判断标准根据就是临床价值,其判定指标是全因死亡率、病发率、健康相干生命质量和不良反应这4个指标。新药制定价格时要求企业递交卷宗,由初期效益评估研究院根据这4项临床价值指标对卷宗进行评估,评价其相对对比疗法的附加价值程度。 在法国,新药进入市场需要经过3道程序——上市审批、价值评估和价格协商。如果药品取得上市许可,将由卫生最高委员会和透明委员会进行医治价值评估,并对医治价值提高程度进行评级(ASMR分级)。在透明委员会评估的基础上,健康产品经济委员会与药企协商价格(包括零售药价格和医院用药价格)。ASMR分级进程也是对药品临床价值判断的进程,根据主要指标是包括:药物的安全性、有效性、质量可控性、允从性、创新性、满足社会需求和其他社会特性。ASMR分级直接决定药品出厂价格高低,创新药品为ASMRI至ASMRⅢ级,常规药品为ASMRIV或ASMRV级,每级别的价格差约为30%。纳入医保目录的药品需到达ASMRⅣ以上,ASMRV的药品要想纳入目录,需要比同类药品便宜才可以。
药品的价值内涵与构成 首先看商品价值。宏观意义上讲,商品价值包括两部份:1部份是商品内在的使用价值,反应商品的本质属性——用处是甚么;另外一部份是商品的市场价值,反应其社会属性,人们愿意为取得使用价值而付出的代价。商品的使用价值需要通过市场价值来体现,同时市场价值更多反应的是消费的意愿和需求。 药品价值一样包括使用价值和市场价值,使用价值就是药品本身的功能,用于医治、诊断、预防人的疾病,也就是药品的使用价值来自于临床;市场价值则是这类临床价值的消费意愿和需求,也就是人们对健康改良或健康水平提高愿意付出的代价。药品关乎人的健康与生命安全,因此其还具有更多的公益性和社会福利属性,药品行业的发展直接关乎政府的公信力,由此,药品还具有另外1个特殊的价值,就是社会价值。 1、临床价值 这是药品最核心的价值,是决定市场价值和社会价值的基础。国际上,很多国家(如德、法等)非常关注药物的临床价值,将其作为药品相干决策的重要根据,如药品的定价、医保目录的遴选、临床用药指南的制定等。 德国从2011 年实行的《医药行业改革法案》( AMONG),将创新药品的附加效益划分为重大、显著、较小、附加效益不可量化、不具有附加效益和效益低于对比疗法6个等级,前3个等级药品具有附加效益,后3个等级不具有附加效益,同时规定如果药品附加效益不被接受,则将该药划入参考价格组来肯定医保支付价格,如果具有附加效益则药企可以和基金委员会协商肯定医保支付价格,常常要比参考价格组肯定的价格高出很多。附加效益的判断标准根据就是临床价值,其判定指标是全因死亡率、病发率、健康相干生命质量和不良反应这4个指标。新药制定价格时要求企业递交卷宗,由初期效益评估研究院根据这4项临床价值指标对卷宗进行评估,评价其相对对比疗法的附加价值程度。 在法国,新药进入市场需要经过3道程序——上市审批、价值评估和价格协商。如果药品取得上市许可,将由卫生最高委员会和透明委员会进行医治价值评估,并对医治价值提高程度进行评级(ASMR分级)。在透明委员会评估的基础上,健康产品经济委员会与药企协商价格(包括零售药价格和医院用药价格)。ASMR分级进程也是对药品临床价值判断的进程,根据主要指标是包括:药物的安全性、有效性、质量可控性、允从性、创新性、满足社会需求和其他社会特性。ASMR分级直接决定药品出厂价格高低,创新药品为ASMRI至ASMRⅢ级,常规药品为ASMRIV或ASMRV级,每级别的价格差约为30%。纳入医保目录的药品需到达ASMRⅣ以上,ASMRV的药品要想纳入目录,需要比同类药品便宜才可以。
 药品的价值内涵与构成 首先看商品价值。宏观意义上讲,商品价值包括两部份:1部份是商品内在的使用价值,反应商品的本质属性——用处是甚么;另外一部份是商品的市场价值,反应其社会属性,人们愿意为取得使用价值而付出的代价。商品的使用价值需要通过市场价值来体现,同时市场价值更多反应的是消费的意愿和需求。 药品价值一样包括使用价值和市场价值,使用价值就是药品本身的功能,用于医治、诊断、预防人的疾病,也就是药品的使用价值来自于临床;市场价值则是这类临床价值的消费意愿和需求,也就是人们对健康改良或健康水平提高愿意付出的代价。药品关乎人的健康与生命安全,因此其还具有更多的公益性和社会福利属性,药品行业的发展直接关乎政府的公信力,由此,药品还具有另外1个特殊的价值,就是社会价值。 1、临床价值 这是药品最核心的价值,是决定市场价值和社会价值的基础。国际上,很多国家(如德、法等)非常关注药物的临床价值,将其作为药品相干决策的重要根据,如药品的定价、医保目录的遴选、临床用药指南的制定等。 德国从2011 年实行的《医药行业改革法案》( AMONG),将创新药品的附加效益划分为重大、显著、较小、附加效益不可量化、不具有附加效益和效益低于对比疗法6个等级,前3个等级药品具有附加效益,后3个等级不具有附加效益,同时规定如果药品附加效益不被接受,则将该药划入参考价格组来肯定医保支付价格,如果具有附加效益则药企可以和基金委员会协商肯定医保支付价格,常常要比参考价格组肯定的价格高出很多。附加效益的判断标准根据就是临床价值,其判定指标是全因死亡率、病发率、健康相干生命质量和不良反应这4个指标。新药制定价格时要求企业递交卷宗,由初期效益评估研究院根据这4项临床价值指标对卷宗进行评估,评价其相对对比疗法的附加价值程度。 在法国,新药进入市场需要经过3道程序——上市审批、价值评估和价格协商。如果药品取得上市许可,将由卫生最高委员会和透明委员会进行医治价值评估,并对医治价值提高程度进行评级(ASMR分级)。在透明委员会评估的基础上,健康产品经济委员会与药企协商价格(包括零售药价格和医院用药价格)。ASMR分级进程也是对药品临床价值判断的进程,根据主要指标是包括:药物的安全性、有效性、质量可控性、允从性、创新性、满足社会需求和其他社会特性。ASMR分级直接决定药品出厂价格高低,创新药品为ASMRI至ASMRⅢ级,常规药品为ASMRIV或ASMRV级,每级别的价格差约为30%。纳入医保目录的药品需到达ASMRⅣ以上,ASMRV的药品要想纳入目录,需要比同类药品便宜才可以。
药品的价值内涵与构成 首先看商品价值。宏观意义上讲,商品价值包括两部份:1部份是商品内在的使用价值,反应商品的本质属性——用处是甚么;另外一部份是商品的市场价值,反应其社会属性,人们愿意为取得使用价值而付出的代价。商品的使用价值需要通过市场价值来体现,同时市场价值更多反应的是消费的意愿和需求。 药品价值一样包括使用价值和市场价值,使用价值就是药品本身的功能,用于医治、诊断、预防人的疾病,也就是药品的使用价值来自于临床;市场价值则是这类临床价值的消费意愿和需求,也就是人们对健康改良或健康水平提高愿意付出的代价。药品关乎人的健康与生命安全,因此其还具有更多的公益性和社会福利属性,药品行业的发展直接关乎政府的公信力,由此,药品还具有另外1个特殊的价值,就是社会价值。 1、临床价值 这是药品最核心的价值,是决定市场价值和社会价值的基础。国际上,很多国家(如德、法等)非常关注药物的临床价值,将其作为药品相干决策的重要根据,如药品的定价、医保目录的遴选、临床用药指南的制定等。 德国从2011 年实行的《医药行业改革法案》( AMONG),将创新药品的附加效益划分为重大、显著、较小、附加效益不可量化、不具有附加效益和效益低于对比疗法6个等级,前3个等级药品具有附加效益,后3个等级不具有附加效益,同时规定如果药品附加效益不被接受,则将该药划入参考价格组来肯定医保支付价格,如果具有附加效益则药企可以和基金委员会协商肯定医保支付价格,常常要比参考价格组肯定的价格高出很多。附加效益的判断标准根据就是临床价值,其判定指标是全因死亡率、病发率、健康相干生命质量和不良反应这4个指标。新药制定价格时要求企业递交卷宗,由初期效益评估研究院根据这4项临床价值指标对卷宗进行评估,评价其相对对比疗法的附加价值程度。 在法国,新药进入市场需要经过3道程序——上市审批、价值评估和价格协商。如果药品取得上市许可,将由卫生最高委员会和透明委员会进行医治价值评估,并对医治价值提高程度进行评级(ASMR分级)。在透明委员会评估的基础上,健康产品经济委员会与药企协商价格(包括零售药价格和医院用药价格)。ASMR分级进程也是对药品临床价值判断的进程,根据主要指标是包括:药物的安全性、有效性、质量可控性、允从性、创新性、满足社会需求和其他社会特性。ASMR分级直接决定药品出厂价格高低,创新药品为ASMRI至ASMRⅢ级,常规药品为ASMRIV或ASMRV级,每级别的价格差约为30%。纳入医保目录的药品需到达ASMRⅣ以上,ASMRV的药品要想纳入目录,需要比同类药品便宜才可以。










