
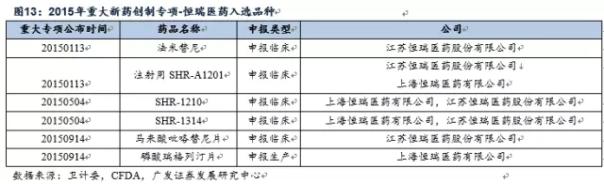
 第2,在重大疾病领域,例如艾滋病、病毒性肝炎、罕见病、恶性肿瘤、儿童疾病领域的新药收获颇丰 例如今年非小细胞肺癌领域的2代EGFR药物-勃林格殷格翰的阿法替尼、3代EGFR药物-阿斯利康的奥希替尼(AZD9291)均有入选,Gilead的重磅丙肝药物-索非(磷)布韦1代和2代产品也纷纭在。
第2,在重大疾病领域,例如艾滋病、病毒性肝炎、罕见病、恶性肿瘤、儿童疾病领域的新药收获颇丰 例如今年非小细胞肺癌领域的2代EGFR药物-勃林格殷格翰的阿法替尼、3代EGFR药物-阿斯利康的奥希替尼(AZD9291)均有入选,Gilead的重磅丙肝药物-索非(磷)布韦1代和2代产品也纷纭在。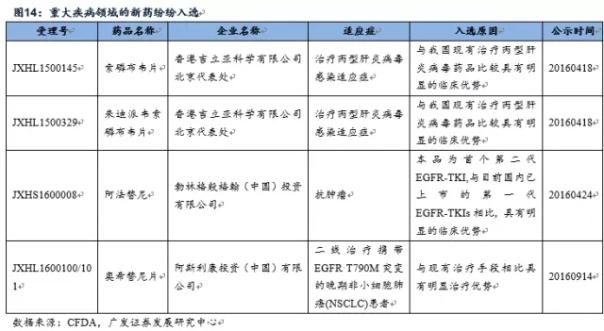 重大疾病领域入选品种外企占多数,预计未来国内企业入选比例会上升。重大疾病领域,诸如艾滋病、病毒性肝炎、罕见病、恶性肿瘤、儿童疾病领域的机会主要集中在跨国药企,通过非重大专项进入优先审评名单的只有6个国产创新药,我们认为随着国内新药研发技术的不断进步,国内企业能够分享到的机会不断增多。 斟酌到国内处于肿瘤、糖尿病、类风湿、病毒性肝炎、心脑血管领域的创新药比较多,所以对比优先审评规定范围,目前国内在恶性肿瘤和病毒性肝炎的上市公司能够分享到1定的政策红利,关注恒瑞医药(具有国内最大的肿瘤创新药研发管线)、正大天晴、和黄中国、百济神州、石药等公司。
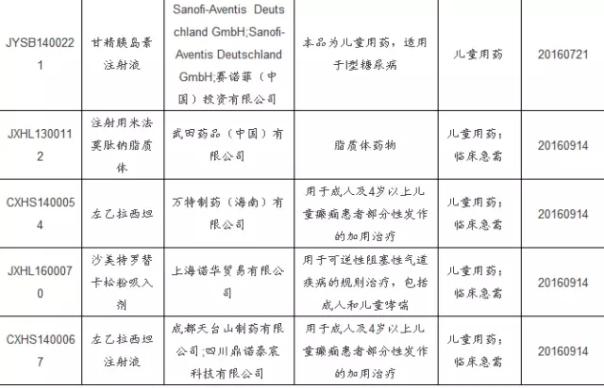
重大疾病领域入选品种外企占多数,预计未来国内企业入选比例会上升。重大疾病领域,诸如艾滋病、病毒性肝炎、罕见病、恶性肿瘤、儿童疾病领域的机会主要集中在跨国药企,通过非重大专项进入优先审评名单的只有6个国产创新药,我们认为随着国内新药研发技术的不断进步,国内企业能够分享到的机会不断增多。 斟酌到国内处于肿瘤、糖尿病、类风湿、病毒性肝炎、心脑血管领域的创新药比较多,所以对比优先审评规定范围,目前国内在恶性肿瘤和病毒性肝炎的上市公司能够分享到1定的政策红利,关注恒瑞医药(具有国内最大的肿瘤创新药研发管线)、正大天晴、和黄中国、百济神州、石药等公司。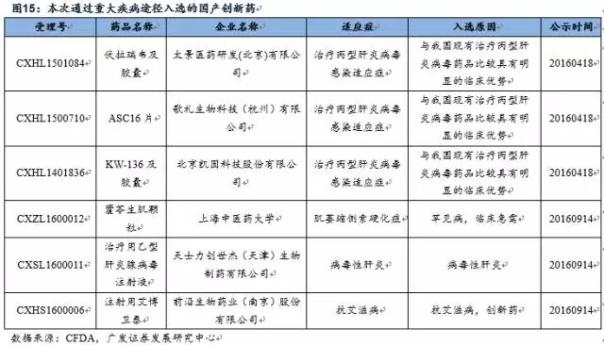 其次,儿童药领域竞争相对和缓,入选占比多,也是可以关注的领域。今年第1批公示的优先审评药物总共有5个品种,均是儿童药,可见CFDA对儿童药10分重视,加上后续的儿童药品种,本次大名单总共有13个品种,占本次大名单比例接近20%,可见儿童药领域的新药研发速度在加快。 贝达药业的氯法拉滨注射液在2012年就已申报生产,1直处于排队状态,借助本次优先审评,上市速度加快,预计于2016年上市,是儿童急性淋巴性白血病的殊效药,中国1年的适应症儿童近4000例。 进入优先审评公示的儿童药品种
其次,儿童药领域竞争相对和缓,入选占比多,也是可以关注的领域。今年第1批公示的优先审评药物总共有5个品种,均是儿童药,可见CFDA对儿童药10分重视,加上后续的儿童药品种,本次大名单总共有13个品种,占本次大名单比例接近20%,可见儿童药领域的新药研发速度在加快。 贝达药业的氯法拉滨注射液在2012年就已申报生产,1直处于排队状态,借助本次优先审评,上市速度加快,预计于2016年上市,是儿童急性淋巴性白血病的殊效药,中国1年的适应症儿童近4000例。 进入优先审评公示的儿童药品种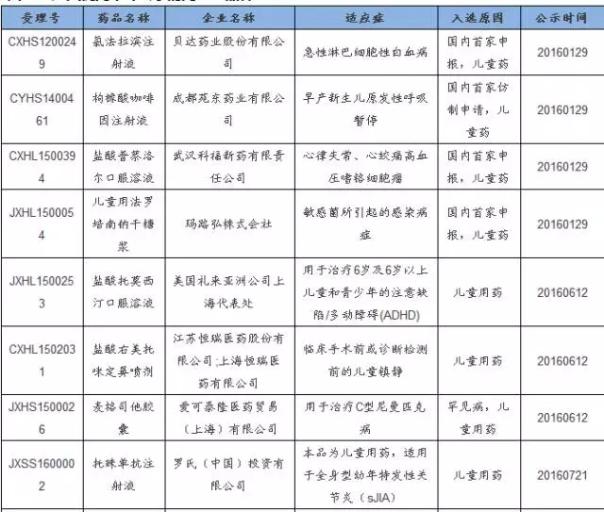
 数据来源:CFDA,广发证券发展研究中心 第3,优先审评推动首仿药上市进程 CFDA优先审评政策对首仿药申请也做出了相干规定,范围为专利到期前3年的药品临床实验申请和专利到期前1年的药品生产申请。 “首仿”品种实行优先审评评定的基本原则,纳入优先审评的“首仿”品种需同时满足以下条件: (1) 同品种唯一1家进口上市; (2) 待审评同品种中,按药品审评中心承办日期前后顺序属于第1家的; (3) 已超越法定审评期限。 其中,同品种指相同活性成份、相同给药途径的产品,并将特殊制剂与普通制剂辨别开,如将微球注射剂与普通注射剂视为两个不同品种。若“首仿”注册申请审评没有通过,则按药品审评中心承办日期前后按序增补后1家申报的注册申请。 优先审评推动首仿药上市进程,上市时间可缩短4年以上。2011⑵014年,国内首仿药的平均评审时间在不断延长,申请临床时间长达28个月,申请上市时间到达42个月,二者合计长达70个月,再加上验证性临床的时间,从申请临床到上市时间超过7年时间。加入优先审评以后,国内首仿的审评审批有望明显加快,乐观的话可以缩短4年以上时间。 斟酌到国内研发回是仿造药为主,国内企业能够分享到的优先审评制度红利,更多地集中在首仿药上。
数据来源:CFDA,广发证券发展研究中心 第3,优先审评推动首仿药上市进程 CFDA优先审评政策对首仿药申请也做出了相干规定,范围为专利到期前3年的药品临床实验申请和专利到期前1年的药品生产申请。 “首仿”品种实行优先审评评定的基本原则,纳入优先审评的“首仿”品种需同时满足以下条件: (1) 同品种唯一1家进口上市; (2) 待审评同品种中,按药品审评中心承办日期前后顺序属于第1家的; (3) 已超越法定审评期限。 其中,同品种指相同活性成份、相同给药途径的产品,并将特殊制剂与普通制剂辨别开,如将微球注射剂与普通注射剂视为两个不同品种。若“首仿”注册申请审评没有通过,则按药品审评中心承办日期前后按序增补后1家申报的注册申请。 优先审评推动首仿药上市进程,上市时间可缩短4年以上。2011⑵014年,国内首仿药的平均评审时间在不断延长,申请临床时间长达28个月,申请上市时间到达42个月,二者合计长达70个月,再加上验证性临床的时间,从申请临床到上市时间超过7年时间。加入优先审评以后,国内首仿的审评审批有望明显加快,乐观的话可以缩短4年以上时间。 斟酌到国内研发回是仿造药为主,国内企业能够分享到的优先审评制度红利,更多地集中在首仿药上。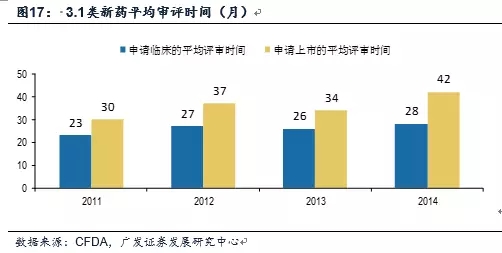 最后,普通仿造药通过国际认证体系可以优先审评,快速上市 相对新药和首仿药而言,普通仿造药很难享遭到快速通道。对普通仿造药来言,由于注册申请众多,即便FDA对ANDA的审评周期1般也会超过30个月,远远落后于新药的审批速度,在国内本次药审改革中,有限的审评审批资源更多地向新药靠拢,分到普通仿造药上的资源就更少了。 国际认证提供普通仿造药(2仿及以后的品种)快速上市通道,是中国药审的特点。国内厂商借助于《CFDA关于解决药品注册申请积存实行优先审评审批的意见》正式稿中的第5种情形,例如“申请人在美国、欧盟同步申请并获准展开药物临床实验的新药临床实验申请;在中国境内用同1生产线生产并在美国、欧盟药品审批机构同步申请上市且通过了其现场检查的药品注册申请”,可以提交优先审评申请。 在今年9月份最近1批公示品种,按此申请优先审评的情形开始出现,其中国际化业务展开较早的企业会在优先审评快速通道中获益匪浅。 9月份展开国际化业务的公司提交优先审评申请
最后,普通仿造药通过国际认证体系可以优先审评,快速上市 相对新药和首仿药而言,普通仿造药很难享遭到快速通道。对普通仿造药来言,由于注册申请众多,即便FDA对ANDA的审评周期1般也会超过30个月,远远落后于新药的审批速度,在国内本次药审改革中,有限的审评审批资源更多地向新药靠拢,分到普通仿造药上的资源就更少了。 国际认证提供普通仿造药(2仿及以后的品种)快速上市通道,是中国药审的特点。国内厂商借助于《CFDA关于解决药品注册申请积存实行优先审评审批的意见》正式稿中的第5种情形,例如“申请人在美国、欧盟同步申请并获准展开药物临床实验的新药临床实验申请;在中国境内用同1生产线生产并在美国、欧盟药品审批机构同步申请上市且通过了其现场检查的药品注册申请”,可以提交优先审评申请。 在今年9月份最近1批公示品种,按此申请优先审评的情形开始出现,其中国际化业务展开较早的企业会在优先审评快速通道中获益匪浅。 9月份展开国际化业务的公司提交优先审评申请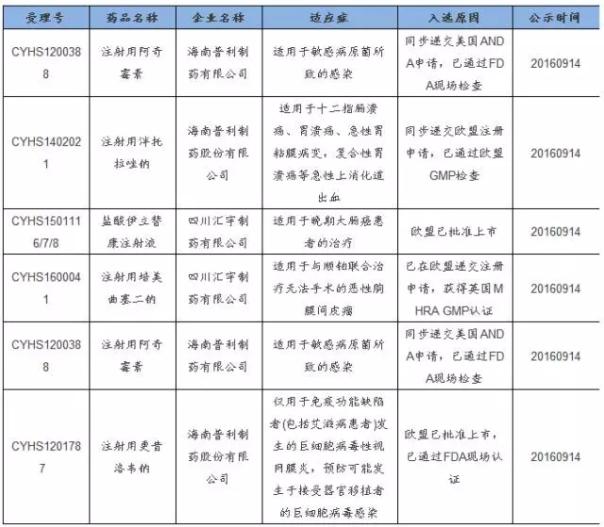 数据来源:CFDA,广发证券发展研究中心
数据来源:CFDA,广发证券发展研究中心










