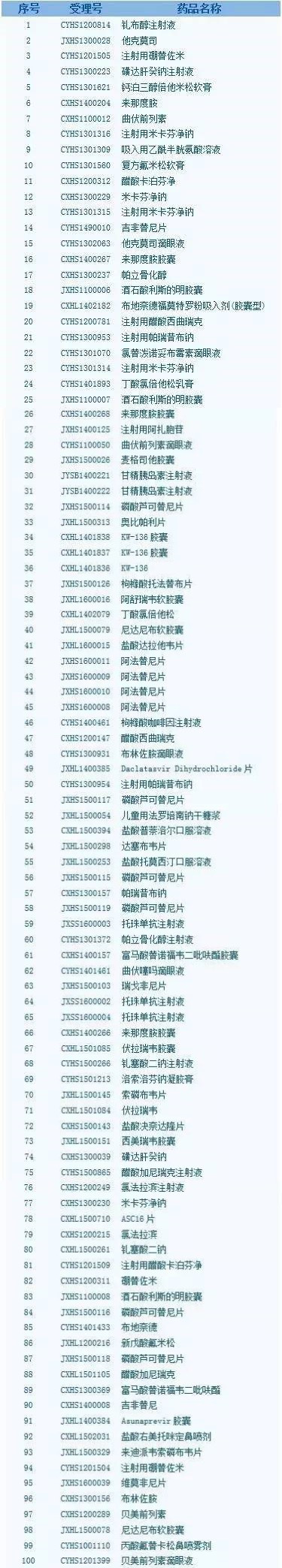
 研发实力哪家强? 据统计,在已优先审评受理品种清单中,有66个受理号来自本土药企。其中,恒瑞有6个,分别是盐酸右美托咪定鼻喷剂、钆布醇注射液、磺达肝癸钠注射液、帕立骨化醇注射液、注射用醋酸卡泊芬净和醋酸卡泊芬净;齐鲁制药6个,分别是吉非替尼、吉非替尼片、他克莫司滴眼液、氯替泼诺妥布霉素滴眼液、布林佐胺滴眼液和布林佐胺。另外,正大天晴、豪森、双鹭药业等均属于研发实力较强的企业,各有5、5、4个受理品种。
研发实力哪家强? 据统计,在已优先审评受理品种清单中,有66个受理号来自本土药企。其中,恒瑞有6个,分别是盐酸右美托咪定鼻喷剂、钆布醇注射液、磺达肝癸钠注射液、帕立骨化醇注射液、注射用醋酸卡泊芬净和醋酸卡泊芬净;齐鲁制药6个,分别是吉非替尼、吉非替尼片、他克莫司滴眼液、氯替泼诺妥布霉素滴眼液、布林佐胺滴眼液和布林佐胺。另外,正大天晴、豪森、双鹭药业等均属于研发实力较强的企业,各有5、5、4个受理品种。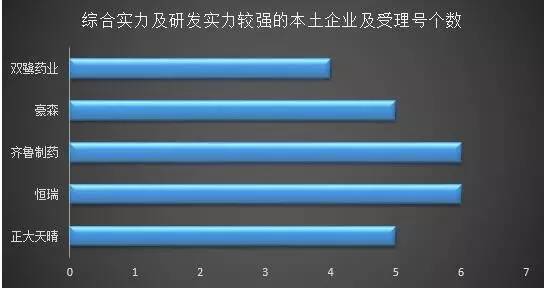 从跨国企业优先审评的品种数量看,截至目前,勃林格殷格翰、诺华、罗氏、艾伯维等14家跨国药企的34个受理号将享受“快车道”待遇。 新药研发热度不减,首仿表现也不俗 从申请类型来看,此次公布品种中,国内注册共62个受理号,其中,新药33个,占53.2%,仿造药29个,占比46.8%。而早前CFDA也曾公布22个拟优先审评的首仿药物名单,这给了国内仿造药企业更大的空间和期待。进口注册共38个受理号,主要为新药,仿造药品种仅占5.3%。
从跨国企业优先审评的品种数量看,截至目前,勃林格殷格翰、诺华、罗氏、艾伯维等14家跨国药企的34个受理号将享受“快车道”待遇。 新药研发热度不减,首仿表现也不俗 从申请类型来看,此次公布品种中,国内注册共62个受理号,其中,新药33个,占53.2%,仿造药29个,占比46.8%。而早前CFDA也曾公布22个拟优先审评的首仿药物名单,这给了国内仿造药企业更大的空间和期待。进口注册共38个受理号,主要为新药,仿造药品种仅占5.3%。 化药研发还是重头戏 从品种分析,100个受理号中有95项是化药申请,5项生物制品申请。化学药研发仍唱“重头戏”。生物制品如何迎头遇上?中药的前途在哪?小编也将延续关注。 附: 已纳入优先审评程序药品品种
化药研发还是重头戏 从品种分析,100个受理号中有95项是化药申请,5项生物制品申请。化学药研发仍唱“重头戏”。生物制品如何迎头遇上?中药的前途在哪?小编也将延续关注。 附: 已纳入优先审评程序药品品种