3个医械注册申请被拒!27家企业撤回32个医械注册申请
发布时间:2017-01-13 10:43:52
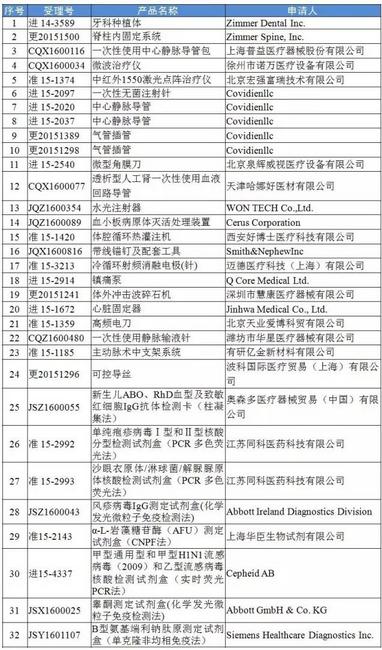
医药网12月19日讯 12月16日。CFDA官网发布了《关于3个医疗器械注册申请项目临床实验监督抽查有关情况的公告》。公告称,2016年10至11月,CFDA组织展开了第2批医疗器械临床实验监督抽查,检查发现3个医疗器械注册申请项目的临床实验存在真实性问题。分别是: 安徽同科生物科技有限公司的人乳头瘤病毒(15个型)核酸分型检测试剂盒(PCR多色荧光法)(受理号:CSZ1600248)、德国Roche Diagnostics GmbH的人T淋巴细胞病毒1型和2型抗体检测试剂盒(电化学发光法)(受理号:JSZ1600012)和日本 LSI Medience Corporation的可溶性CD14亚型检测试剂盒(化学发光免疫法)(受理号:JSZ1600078)3个注册申请项目临床实验进程中存在样本重复使用,且临床实验方案中没有设计样本重复使用、实验报告对样本重复使用无特别说明。 依照医疗器械注册有关规定,CFDA对上述3个存在真实性问题的注册申请项目不予注册,自不予注册之日起1年内不予再次受理,对触及的临床实验机构及相干责任人要求相干省级食品药品监督管理局依照《医疗器械监督管理条例》的有关规定调查处理,并向总局报告处理结果。 另外,CFDA官网还发布了《关于公布27家企业撤回32个医疗器械注册申请项目的公告》。10月20日⑴2月12日,共有27家企业撤回32个医疗器械注册申请项目。 撤回医疗器械注册申请项目清单