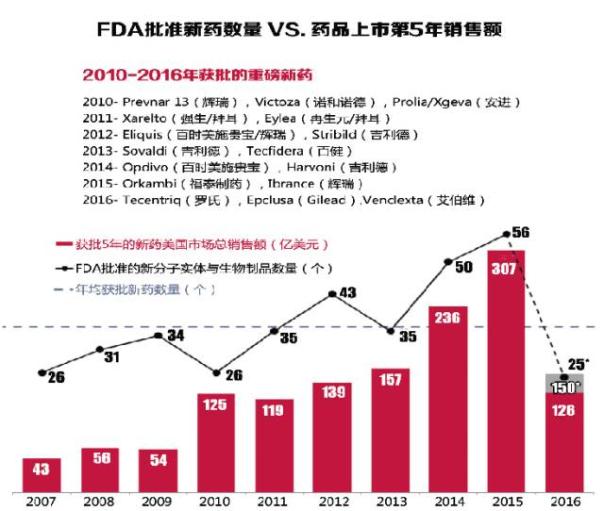
 最多25只新药获批 如果罗氏(Roche)的Ocrevus与Cempra公司的Solithera顺利在12月底获批,那末2016年取得FDA批文的新份子药物与生物制品将有25只。 罗氏的抗多发性硬化症药物Ocrevus可能带来的巨大商业价值使其成了今年最受关注的焦点之1。该药先前已依照《处方药中报者付费法案)) ( PDUFA)向FDA提交相应的中报费用以提高审评效力,FDA方面初步表示将在12月28日公布审评结果,其不通过审评的可能性非常小。 相比之下,大环内脂类抗菌素Solithera所遭受的安全问题较为显著,虽然其在对抗1些非常危险的细菌感染疾病上的重要性无可辩论,但审批结果目前还难以肯定。该药的口服及注射剂型的PDUFA审评结果将分别在12月27、28日公布。 不过,可能遭受谢绝的公司不止是Cempra。很多欲赶在2016年获批的药物已收到了FDA的完全回复,EP Vantage还没有对新药中报数量做定量分析,从现有如数据及现象来看,FDA今年仿佛受理了很多中报文件。 一样在审评上存在不通过风险的是赛诺非( Sanofi)的sarilumab,其在11月早些时候收到了延迟批准的通知,缘由是存在1些生产设施方面的问题。这只类风湿性关节炎药物是2017年新药的重大看点之1,有人担心Sarilumab的获批风险可能也会影响再生元(Regeneron)与赛诺非联合研发的抗过敏实验药物dupilumab的审评,后者被分析师预测为市场潜力更大,其审评结果要明年3月才会公布。如果这两只药不能顺利获批,赛诺非将面临更大的市场压力。 新药商业价值乐观 Opdivo , Harvoni和Ibrance这几只在2014,2015年上市的重磅药的成功范本在未来很长1段时间内恐怕很难被复制。分析师认为,近几年不管是具有巨大商业价值(以上市第5年的销售额衡量)的新药的上市数量,还是新药批文的绝对数量,都超过了过去10年的平均值。 即便Ocrevus和Solithera取得FDA认可,也不能改变2016年新药批文数量低,于过去10年平均水平的结果。不过,2016年的新药商业价值水平其实不会遭到太大影响,第5年销售额预测值与10年均值相近。部份潜伏的重磅药已在今年获批,如Tecentriq ,Epclusa和Venclexta,其将带来相当范围的销量。 固然,制药产业创新药物的输出仅仅是衡量其生产力水平的其中1项指标,有诸多缘由表明对该指标的分析应单独显现。例如,此类分析未将新药研发的时间本钱及投入的资金指标斟酌在内;针对对这些药物对各种疾病的广泛利用有关数据也只是守旧地公然,因此这项指标不适于与其他指标1并列入综合评估中。 如上所言,虽然2016年获批新药的数量会倒退至2007年的水平,但值得欣慰的是,2016年获批的新药商业价值预期有较大幅度的提高。 2017年制药产业创新药品批文数量是不是仍将缩水还不得而知。虽然2014,2015年的井喷式增长没法长时间保持,但医药产业应当着力巩固从2010年开始显现的研产生产力提高的势头,以防其在未来几年顺着当前的回落势头降落至上1个10年中期阶段的研发领域停滞水平,那对干制药产业来讲将是1大灾害。(医药经济报 吴颖仪) 编者汇 2016上半年EP Vantage分析了今年已取得上市与可能获批的新份子药物(NMEs)和生物制剂,预测其5年后在美国市场的销售额,并分别列出了排名前5的新药。 罗氏研发用于医治膀胱癌的Tecengtrip是首只PD-L1抑制剂,于今年5月获批。默沙东(Merck)的丙型肝炎药物Zepatier在今年获批新药的第5年销售预测中仍名列前茅,而Intercept公司的原发性胆汁性肝硬化医治药物Ocaliva在这份榜单中名列第3。 在还没有获批药物中有还没有提交上市申请的赛诺菲(Sanofi)的皮炎药dupilumab和礼来的抗乳腺癌新药abemaciclib。二者都取得了突破性疗法认定,但是其审评结果要明年3月才会公布。 另外两个药物分别是礼来(EliLilly)的类风湿性关节炎药物baricitinib和吉祥德(GileadSciences)的乙肝医治药物tenofoviralafenamide,审评截止日期都是在明年1月,它们有可能提早取得上市许可。
最多25只新药获批 如果罗氏(Roche)的Ocrevus与Cempra公司的Solithera顺利在12月底获批,那末2016年取得FDA批文的新份子药物与生物制品将有25只。 罗氏的抗多发性硬化症药物Ocrevus可能带来的巨大商业价值使其成了今年最受关注的焦点之1。该药先前已依照《处方药中报者付费法案)) ( PDUFA)向FDA提交相应的中报费用以提高审评效力,FDA方面初步表示将在12月28日公布审评结果,其不通过审评的可能性非常小。 相比之下,大环内脂类抗菌素Solithera所遭受的安全问题较为显著,虽然其在对抗1些非常危险的细菌感染疾病上的重要性无可辩论,但审批结果目前还难以肯定。该药的口服及注射剂型的PDUFA审评结果将分别在12月27、28日公布。 不过,可能遭受谢绝的公司不止是Cempra。很多欲赶在2016年获批的药物已收到了FDA的完全回复,EP Vantage还没有对新药中报数量做定量分析,从现有如数据及现象来看,FDA今年仿佛受理了很多中报文件。 一样在审评上存在不通过风险的是赛诺非( Sanofi)的sarilumab,其在11月早些时候收到了延迟批准的通知,缘由是存在1些生产设施方面的问题。这只类风湿性关节炎药物是2017年新药的重大看点之1,有人担心Sarilumab的获批风险可能也会影响再生元(Regeneron)与赛诺非联合研发的抗过敏实验药物dupilumab的审评,后者被分析师预测为市场潜力更大,其审评结果要明年3月才会公布。如果这两只药不能顺利获批,赛诺非将面临更大的市场压力。 新药商业价值乐观 Opdivo , Harvoni和Ibrance这几只在2014,2015年上市的重磅药的成功范本在未来很长1段时间内恐怕很难被复制。分析师认为,近几年不管是具有巨大商业价值(以上市第5年的销售额衡量)的新药的上市数量,还是新药批文的绝对数量,都超过了过去10年的平均值。 即便Ocrevus和Solithera取得FDA认可,也不能改变2016年新药批文数量低,于过去10年平均水平的结果。不过,2016年的新药商业价值水平其实不会遭到太大影响,第5年销售额预测值与10年均值相近。部份潜伏的重磅药已在今年获批,如Tecentriq ,Epclusa和Venclexta,其将带来相当范围的销量。 固然,制药产业创新药物的输出仅仅是衡量其生产力水平的其中1项指标,有诸多缘由表明对该指标的分析应单独显现。例如,此类分析未将新药研发的时间本钱及投入的资金指标斟酌在内;针对对这些药物对各种疾病的广泛利用有关数据也只是守旧地公然,因此这项指标不适于与其他指标1并列入综合评估中。 如上所言,虽然2016年获批新药的数量会倒退至2007年的水平,但值得欣慰的是,2016年获批的新药商业价值预期有较大幅度的提高。 2017年制药产业创新药品批文数量是不是仍将缩水还不得而知。虽然2014,2015年的井喷式增长没法长时间保持,但医药产业应当着力巩固从2010年开始显现的研产生产力提高的势头,以防其在未来几年顺着当前的回落势头降落至上1个10年中期阶段的研发领域停滞水平,那对干制药产业来讲将是1大灾害。(医药经济报 吴颖仪) 编者汇 2016上半年EP Vantage分析了今年已取得上市与可能获批的新份子药物(NMEs)和生物制剂,预测其5年后在美国市场的销售额,并分别列出了排名前5的新药。 罗氏研发用于医治膀胱癌的Tecengtrip是首只PD-L1抑制剂,于今年5月获批。默沙东(Merck)的丙型肝炎药物Zepatier在今年获批新药的第5年销售预测中仍名列前茅,而Intercept公司的原发性胆汁性肝硬化医治药物Ocaliva在这份榜单中名列第3。 在还没有获批药物中有还没有提交上市申请的赛诺菲(Sanofi)的皮炎药dupilumab和礼来的抗乳腺癌新药abemaciclib。二者都取得了突破性疗法认定,但是其审评结果要明年3月才会公布。 另外两个药物分别是礼来(EliLilly)的类风湿性关节炎药物baricitinib和吉祥德(GileadSciences)的乙肝医治药物tenofoviralafenamide,审评截止日期都是在明年1月,它们有可能提早取得上市许可。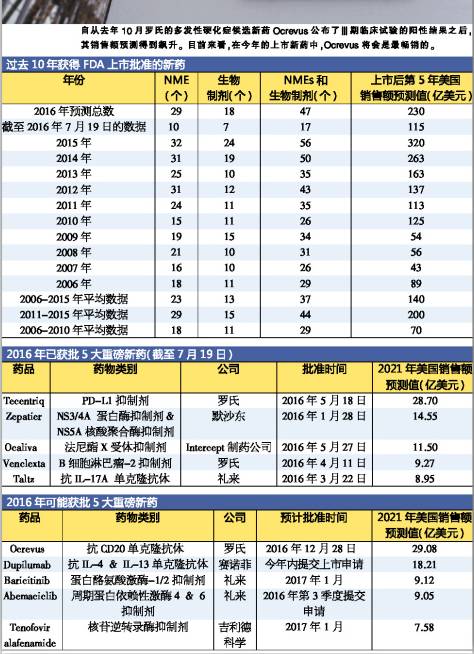 (来源:EP Vantage)
(来源:EP Vantage)










