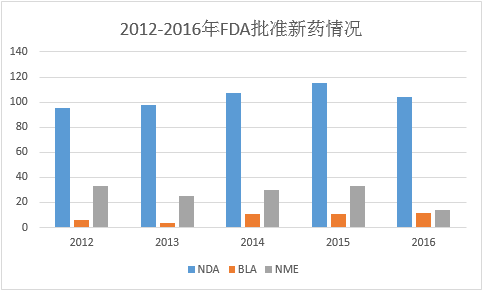
 图1数据来源:中国医药工业信息中心,中国新药研发监测数据库(CPM) 生物仿造药粉墨登场,将带动全球市场格局的变化 2016可谓生物仿造药元年,随着Sandoz生产的Zarxio(filgrastim-sndz)作为第1个生物仿造药取得FDA批准上市,生物仿造药于2015年开始正式走向美国这1最大的医药市场,并在今年显现井喷态势,已有3个品种正式取得FDA批准上市,另有3个在等待审批的进程中。今年获批上市的3个生物仿造药分别是Remicade®(infliximab)的1种生物仿造药Inflectra,由美国辉瑞公司和韩国赛尔群公司(Celltrion)联合开发,于今年4月5日得到批准,成为第1个单克隆抗体生物仿造药,用于类风湿性关节炎、银屑病等炎症性疾病的医治;Sandoz开发的Enbrel(etanercept)生物类似药Erelzi(etanercept-szzs),用于医治多种炎症疾病,是FDA批准的第3个生物类似药;最后1个是安进公司生产的Amjevita(adalimumab-atto,阿达木单抗),可用于艾伯维品牌药Humira(修美乐,通用名:adalimumab,阿达木单抗)全部的适应症。去年,安进宣布正在开发9个重磅生物药的仿造药,并计划在2017年开始陆续将产品推向市场。安进表示,这些产品终究将带来超过30亿美元的年销售额。Amjevita便是其中1个! 这些生物仿造药的原研药品本身都是当年上市的重磅药物,曾创下极佳的销售事迹,随着这些生物仿造药的上市,必定会带动全球药品市场格局的变动,Remicade®(infliximab)的生物仿造药Inflectra就已为Remicade®的销售带来了不小的冲击,去年同比降落了4%。而美国作为全球举足轻重的医药市场,他的生物仿造药审批政策可以为此类医药企业提供相当有用的参考价值,如生物等效性评价、专利规避、临床适应症等。
图1数据来源:中国医药工业信息中心,中国新药研发监测数据库(CPM) 生物仿造药粉墨登场,将带动全球市场格局的变化 2016可谓生物仿造药元年,随着Sandoz生产的Zarxio(filgrastim-sndz)作为第1个生物仿造药取得FDA批准上市,生物仿造药于2015年开始正式走向美国这1最大的医药市场,并在今年显现井喷态势,已有3个品种正式取得FDA批准上市,另有3个在等待审批的进程中。今年获批上市的3个生物仿造药分别是Remicade®(infliximab)的1种生物仿造药Inflectra,由美国辉瑞公司和韩国赛尔群公司(Celltrion)联合开发,于今年4月5日得到批准,成为第1个单克隆抗体生物仿造药,用于类风湿性关节炎、银屑病等炎症性疾病的医治;Sandoz开发的Enbrel(etanercept)生物类似药Erelzi(etanercept-szzs),用于医治多种炎症疾病,是FDA批准的第3个生物类似药;最后1个是安进公司生产的Amjevita(adalimumab-atto,阿达木单抗),可用于艾伯维品牌药Humira(修美乐,通用名:adalimumab,阿达木单抗)全部的适应症。去年,安进宣布正在开发9个重磅生物药的仿造药,并计划在2017年开始陆续将产品推向市场。安进表示,这些产品终究将带来超过30亿美元的年销售额。Amjevita便是其中1个! 这些生物仿造药的原研药品本身都是当年上市的重磅药物,曾创下极佳的销售事迹,随着这些生物仿造药的上市,必定会带动全球药品市场格局的变动,Remicade®(infliximab)的生物仿造药Inflectra就已为Remicade®的销售带来了不小的冲击,去年同比降落了4%。而美国作为全球举足轻重的医药市场,他的生物仿造药审批政策可以为此类医药企业提供相当有用的参考价值,如生物等效性评价、专利规避、临床适应症等。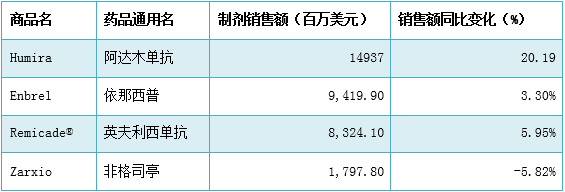 表1数据来源:中国医药工业信息中心,PDB药物综合数据库 FDA的新药审批工作卓效显著 FDA在今年的药品加速审批中获得卓效进展,突破疗法认定、优先审评、快速审批通道和罕用药地位等都是今年FDA加速审批的重要策略。根据CPM数据库统计显示,在今年的批准新药中,有32%(6个)药物取得突破性疗法认定,68%(13个)取得优先审评,37%(7个)取得罕用药地位,这为新药研发中创新药品的快速上市及罕用药的临床利用都带来了重要的意义。 新药批准热门领域集中,重磅药物层见叠出 2016年,从批准新药的医治领域散布来看,神经系统用药、抗感染用药和抗肿瘤用药的批准数量名列前茅,占据总批准数量的50%以上。 2016年FDA批准新药的医治领域散布情况
表1数据来源:中国医药工业信息中心,PDB药物综合数据库 FDA的新药审批工作卓效显著 FDA在今年的药品加速审批中获得卓效进展,突破疗法认定、优先审评、快速审批通道和罕用药地位等都是今年FDA加速审批的重要策略。根据CPM数据库统计显示,在今年的批准新药中,有32%(6个)药物取得突破性疗法认定,68%(13个)取得优先审评,37%(7个)取得罕用药地位,这为新药研发中创新药品的快速上市及罕用药的临床利用都带来了重要的意义。 新药批准热门领域集中,重磅药物层见叠出 2016年,从批准新药的医治领域散布来看,神经系统用药、抗感染用药和抗肿瘤用药的批准数量名列前茅,占据总批准数量的50%以上。 2016年FDA批准新药的医治领域散布情况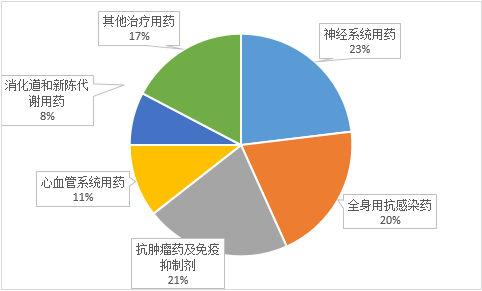 图2数据来源:中国医药工业信息中心,中国新药研发监测数据库(CPM) 其中值得1提的重磅药物有: 抗肿瘤药物Tecentriq,基因泰克(罗氏子公司)研发的用于医治膀胱癌药物atezolizumab注射剂,是FDA批准的首个PD⑴/PD-L1抑制剂。后又因其在肺癌患者的3期临床实验中疗效显著,于今年10月18日再次取得FDA批准新适应症,成为非小细胞肺癌医治的重磅药物。 抗丙肝药物Zepatier,美国默克公司的格佐普韦-依巴司韦(Grazoprevir-Elbasvir)口服制剂,用于基因型1和4(GT⑴,GT⑷)慢性丙型肝炎病毒感染者医治。是继吉祥德Harvoni和艾伯维Viekira以后,获批上市的全球第3款突破性丙肝鸡尾酒疗法。 抗肿瘤药物Vencleta,艾伯维公司的医治慢性淋巴细胞白血病药物venetoclax口服片剂,用于医治染色体17p基因缺失的慢性淋巴白血病患者,是FDA批准的首个B细胞淋巴瘤⑵(BCL⑵)抑制剂。 抗帕金森病药物Nuplazid,美国生物制药公司Acadia Pharmaceuticals推出的首个获批用于医治帕金森(PD)患者所经历幻觉和妄图等精神症状的药物。 软组织赘瘤新药Lartruvo,是40年以来首个医治软组织赘瘤的突破性药物,与多柔比星联合医治成人软组织赘瘤,由礼来研产生产,通过快速审评通道于今年10月19号被FDA批准上市。
图2数据来源:中国医药工业信息中心,中国新药研发监测数据库(CPM) 其中值得1提的重磅药物有: 抗肿瘤药物Tecentriq,基因泰克(罗氏子公司)研发的用于医治膀胱癌药物atezolizumab注射剂,是FDA批准的首个PD⑴/PD-L1抑制剂。后又因其在肺癌患者的3期临床实验中疗效显著,于今年10月18日再次取得FDA批准新适应症,成为非小细胞肺癌医治的重磅药物。 抗丙肝药物Zepatier,美国默克公司的格佐普韦-依巴司韦(Grazoprevir-Elbasvir)口服制剂,用于基因型1和4(GT⑴,GT⑷)慢性丙型肝炎病毒感染者医治。是继吉祥德Harvoni和艾伯维Viekira以后,获批上市的全球第3款突破性丙肝鸡尾酒疗法。 抗肿瘤药物Vencleta,艾伯维公司的医治慢性淋巴细胞白血病药物venetoclax口服片剂,用于医治染色体17p基因缺失的慢性淋巴白血病患者,是FDA批准的首个B细胞淋巴瘤⑵(BCL⑵)抑制剂。 抗帕金森病药物Nuplazid,美国生物制药公司Acadia Pharmaceuticals推出的首个获批用于医治帕金森(PD)患者所经历幻觉和妄图等精神症状的药物。 软组织赘瘤新药Lartruvo,是40年以来首个医治软组织赘瘤的突破性药物,与多柔比星联合医治成人软组织赘瘤,由礼来研产生产,通过快速审评通道于今年10月19号被FDA批准上市。










